Świat baterii - część 3

Niewiele rzeczy jest tak dobrych, aby nie można było ich ulepszyć. Reguła ta odnosi się również do baterii - XIX-wieczne modele były wielokrotnie doskonalone, aż przybrały obecną formę. Dotyczy to także ogniwa Leclanchégo.
Ogniwo do poprawy
Konstrukcja francuskiego chemika została zmieniona przez Carla Gassnera w prawdziwie użyteczny model: tani w produkcji i bezpieczny w eksploatacji. Jednak nadal borykano się z problemami - cynkowa powłoka ogniwa ulegała korozji w kontakcie z kwaśnym elektrolitem wypełniającym kubek, wylanie żrącej zawartości mogło zaś zniszczyć zasilane urządzenie. Rozwiązaniem stało się amalgamowanie wewnętrznej powierzchni cynkowej obudowy (powlekanie jej warstwą rtęci).
Amalgamat cynku praktycznie nie reaguje z kwasami, zachowuje za to wszystkie własności elektrochemiczne czystego metalu. Ze względu na regulacje prawne dotyczące ochrony środowiska coraz rzadziej stosuje się jednak ten sposób wydłużenia życia ogniw (na ogniwach bezrtęciowych można spotkać napis 0% mercury lub mercury free) (1).
Innym sposobem zwiększenia trwałości i wydłużenia czasu pracy ogniwa jest dodanie chlorku cynku ZnCl2 do pasty wypełniającej kubek. Ogniwa o tej konstrukcji często noszą angielską nazwę Heavy Duty i (jak sama nazwa wskazuje) przeznaczone są do zasilania urządzeń bardziej wymagających energetycznie.
Przełomem w dziedzinie baterii jednorazowego użytku stało się skonstruowanie w roku 1955 ogniwa alkalicznego. Wynalazek autorstwa kanadyjskiego inżynier Lewisa Urry’ego, zatrudnionego w obecnej firmie Energizer, ma budowę nieco odmienną niż ogniwo Leclanchégo.
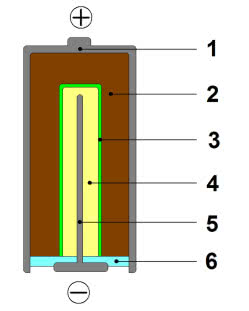
Przede wszystkim nie znajdziecie tam ani grafitowej katody, ani cynkowego kubeczka. Obie elektrody występują w postaci wilgotnych, odseparowanych od siebie past (substancje zagęszczające plus reagenty: katoda składa się z mieszaniny dwutlenku manganu z grafitem, anoda z pyłu cynkowego zmieszanego z wodorotlenkiem potasu), a ich wyprowadzenia wykonane są z metalu (2). Jednak reakcje zachodzące podczas pracy są bardzo podobne do tych, które mają miejsce w ogniwie Leclanchégo.
Zadanie. Przeprowadź "chemiczną sekcję" ogniwa alkalicznego, aby przekonać się, że jego zawartość ma rzeczywiście zasadowy odczyn (3). Pamiętaj, że obowiązują środki ostrożności takie same, jak przy rozbiórce ogniwa Leclanchégo. Jak rozpoznać ogniwo alkaliczne, dowiesz się z ramki "Bateryjny szyfr".
Domowe akumulatorki
Ogniwa, które po zużyciu można powtórnie naładować, od początku rozwoju nauki o elektryczności były "na celowniku" konstruktorów, stąd też mnogość ich typów.
Obecnie jednym z modeli stosowanych do zasilania drobnego sprzętu domowego są akumulatory niklowo-kadmowe. Ich pierwowzór pochodzi z roku 1899, kiedy to szwedzki wynalazca Ernst Jungner zgłosił patent na akumulator niklowo-kadmowy, mogący konkurować z - powszechnie już wtedy stosowanym w motoryzacji - akumulatorem ołowiowym.
Anodę ogniwa stanowił kadm, katodę związek niklu trójwartościowego, natomiast elektrolitem był roztwór wodorotlenku potasu (we współczesnych "suchych" konstrukcjach jest to wilgotna pasta ze środków zagęszczających, nasycona roztworem KOH). W akumulatorach Ni-Cd (takie jest ich oznaczenie) napięcie pracy wynosi ok. 1,2 V - to mniej niż w przypadku ogniw jednorazowych, co jednak dla większości zastosowań nie stanowi problemu. Dużą zaletą jest możliwość czerpania prądu o znacznym natężeniu (nawet kilka amperów) oraz szeroki przedział temperatury pracy.
Wadę akumulatorów niklowo-kadmowych stanowi uciążliwy "efekt pamięciowy". Pojawia się on przy częstym ładowania częściowo tylko wyczerpanych ogniw Ni-Cd: układ zachowuje się tak, jakby jego pojemność równa była wyłącznie ładunkowi uzupełnionemu podczas doładowania. W niektórych typach ładowarek "efekt pamięciowy" można zmniejszyć, ładując ogniwa w specjalnym trybie.
Wyczerpane akumulatory NiCd należy zatem ładować w pełnym cyklu: najpierw całkowite rozładowanie (za pomocą odpowiedniej funkcji ładowarki), dopiero potem ładowanie. Częste doładowywanie zmniejsza ponadto trwałość szacowaną na 1000-1500 cykli (tyle jednorazowych ogniw w czasie swego życia zastąpi jeden akumulator, zatem większy koszt zakupu zwróci się wielokrotnie, nie mówiąc już o znacznie mniejszym obciążeniu środowiska produkcją i utylizacją ogniw).
Ogniwa Ni-Cd zawierające toksyczny kadm zastępowane są akumulatorami niklowo-wodorkowymi (oznaczenie Ni-MH). Ich budowa zbliżona jest do akumulatorów Ni-Cd, ale zamiast kadmu stosuje się porowaty stop metali (Ti, V, Cr, Fe, Ni, Zr, metale ziem rzadkich) o zdolności do absorpcji wodoru (4). Napięcie robocze ogniwa Ni-MH wynosi także ok. 1,2 V, co sprawia, że można stosować je zamiennie z akumulatorami NiCd. Pojemność ogniw niklowo-wodorkowych jest większa niż niklowo-kadmowych o identycznych rozmiarach. Układy NiMH ulegają jednak szybszemu samorozładowaniu. Istnieją już nowoczesne konstrukcje pozbawione tej wady, ale kosztują znacznie więcej niż standardowe modele.
Akumulatory niklowo-wodorkowe nie wykazują "efektu pamięciowego" (można doładowywać częściowo wyczerpane ogniwa). Zawsze jednak trzeba sprawdzić wymogi ładowania poszczególnych typów w instrukcji obsługi ładowarki (5).
W przypadku akumulatorów Ni-Cd oraz Ni-MH nie zalecamy ich rozbiórki. Po pierwsze, nie znajdziemy niczego przydatnego w ich wnętrzu. Po drugie, nikiel i kadm nie należą do bezpiecznych pierwiastków. Nie ryzykuj niepotrzebnie, a utylizację pozostaw przygotowanym do niej specjalistom.
Król akumulatorów, czyli…
…akumulator kwasowo-ołowiowy, został skonstruowany w roku 1859 przez francuskiego fizyka Gastona Plantego (tak, tak - urządzeniu "stuknie" już w tym roku 161 lat!). Elektrolitem w akumulatorze jest ok. 37% roztwór kwasu siarkowego(VI), a elektrodami są ołów (anoda) oraz ołów pokryty warstwą dwutlenku ołowiu PbO2 (katoda). Podczas pracy na elektrodach tworzy się osad siarczanu(VI) ołowiu( II) PbSO4. Po naładowaniu pojedyncze ogniwo ma napięcie wynoszące ponad 2 wolty.
Akumulator ołowiowy ma właściwie same wady: znaczny ciężar, wrażliwość na rozładowanie i niskie temperatury, konieczność przechowywania w stanie naładowanym, niebezpieczeństwo wycieku żrącego elektrolitu i zastosowanie toksycznego metalu. Ponadto wymaga troskliwej obsługi: kontroli gęstości elektrolitu, uzupełniania wody w komorach (używaj tylko destylowanej lub dejonizowanej), kontroli napięcia (spadek poniżej 1,8 V w pojedynczej komorze grozi uszkodzeniem elektrod) i specjalnego trybu ładowania.
Dlaczego zatem wiekowa konstrukcja nadal jest w użyciu? "Król akumulatorów" ma to, co jest atrybutem prawdziwego władcy - moc. Czerpanie prądu o dużym natężeniu i wysoka wydajność energetyczna sięgająca 75% (tyle energii zużytej do naładowania można odzyskać podczas pracy), a także prostota konstrukcji i niskie koszty produkcji powodują, że akumulator ołowiowy stosowany jest nie tylko do rozruchu silników spalinowych, ale również jako element awaryjnego zasilania. Mimo 160-letniej historii akumulator ołowiowy nadal ma się dobrze i nie został wyparty przez inne typy tych urządzeń (a wraz z nim i sam ołów, który dzięki akumulatorowi należy do metali produkowanych w największych ilościach). Dopóki rozwijać się będzie motoryzacja oparta o silniki spalinowe, prawdopodobnie nic nie zagrozi jego pozycji (6).
Wynalazcy nie ustawali w próbach konstrukcji zamienników akumulatora ołowiowego. Niektóre z modeli przyjęły się i do dzisiaj stosowane są w motoryzacji. Na przełomie wieków XIX i XX powstały konstrukcje, w których nie używano roztworu H2SO4, lecz elektrolitów o odczynie zasadowym. Przykładem jest zaprezentowany wyżej akumulator niklowo-kadmowy autorstwa Ernsta Jungnera. W roku 1901 Thomas Alva Edison zmodyfikował konstrukcję, stosując żelazo zamiast kadmu. W porównaniu z akumulatorami kwasowymi modele zasadowe są znacznie lżejsze i mogą pracować w niskich temperaturach, nie są również tak kłopotliwe w obsłudze. Jednak ich produkcja jest droższa, a wydajność energetyczna - niższa.
I co dalej?
Artykuły poświęcone bateriom nie wyczerpały oczywiście problematyki chemicznych źródeł prądu. Nie poruszono w nich np. zagadnień dotyczących ogniw litowych, również często spotykanych do zasilania domowego sprzętu, np. kalkulatorów czy płyt głównych komputerów. Więcej o nich znajdziecie w artykule styczniowym dotyczącym ubiegłorocznego Nobla z chemii, a od strony praktycznej - za miesiąc (z rozbiórką i doświadczeniami włącznie).
Przed ogniwami, a zwłaszcza akumulatorami, rysują się dobre perspektywy. Świat staje się coraz bardziej mobilny, co oznacza konieczność uniezależnienia się od kabli zasilających. Wielkim wyzwaniem jest również zapewnienie wydajnego zasilania dla pojazdów elektrycznych - tak, aby mogły one konkurować z autami napędzanymi silnikiem spalinowym również pod względem ekonomicznym.
Bateryjny szyfr
W celu ułatwienia identyfikacji rodzaju ogniw, wprowadzono specjalny kod liczbowo-literowy. Dla typów najczęściej spotykanych w naszych domach do zasilania drobnego sprzętu ma on postać: liczba-litera-litera-liczba.
I tak:
- pierwsza liczba oznacza liczbę ogniw; pomijana dla ogniw pojedynczych;
- pierwsza litera oznacza typ ogniwa. Gdy jej brak, masz do czynienia z ogniwem Leclanchégo. Pozostałe typy ogniw oznacza się następująco:
C - ogniwo litowe (najczęściej spotykany typ),
H - akumulator Ni-MH,
K - akumulator Ni-Cd,
L - ogniwo alkaliczne;
- kolejna litera oznacza kształt ogniwa:
F - płytkowe,
R - cylindryczne,
P - ogólne oznaczenie ogniw o kształtach innych niż cylindryczne;
- końcowa liczba lub liczby oznaczają rozmiar ogniwa (wartości katalogowe lub wprost podające wymiary) (7).
Przykłady oznaczeń:
R03 - ogniwo cynkowo-grafitowe o rozmiarach "małego paluszka". Inne oznaczenie to AAA lub micro.
LR6 - ogniwo alkaliczne o rozmiarach "paluszka". Inne oznaczenie to AA lub mignon.
HR14 - akumulator Ni-MH; jako oznaczenie rozmiaru stosuje się także literę C.
KR20 - akumulator Ni-Cd o rozmiarze oznaczanym również literą D.
3LR12 - płaska bateria o napięciu 4,5 V, składająca się z trzech ogniw alkalicznych o kształcie cylindrycznym.
6F22 - bateria o napięciu 9 V, składająca się z sześciu płaskich ogniw Leclanchégo.
CR2032 - ogniwo litowe o średnicy 20 mm i grubości 3,2 mm.
Krzysztof Orliński