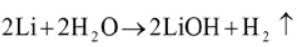Recykling chemicznych źródeł prądu

Zbiórka
Z jaką skalą problemu mamy do czynienia? Raport Głównego Inspektora Ochrony Środowiska za rok 2011 podaje, że na polski rynek wprowadzono ponad 400 milionów sztuk ogniw i akumulatorów. W przybliżeniu tyle samo skończyło swój żywot.
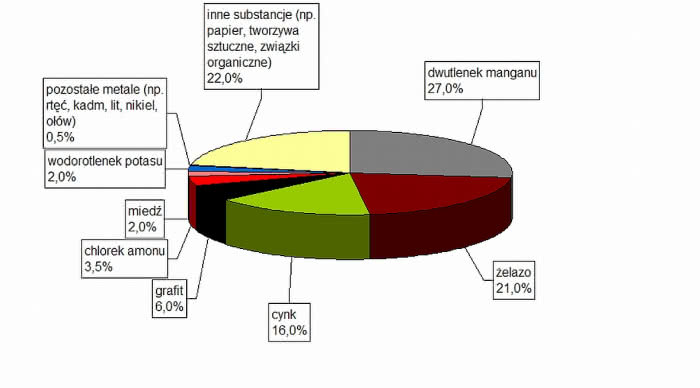
Mamy więc do zagospodarowania ok. 92 tysięcy ton niebezpiecznych odpadów zawierających metale ciężkie (rtęć, kadm, nikiel, srebro, ołów) oraz szereg związków chemicznych (wodorotlenek potasu, chlorek amonu, dwutlenek manganu, kwas siarkowy) (rys. 1). Gdy je wyrzucimy - po skorodowaniu powłoki - skażą glebę i wody (rys. 2). Nie róbmy takiego "prezentu" środowisku, a w konsekwencji sobie samym. Z tej ilości 34% trafiło do wyspecjalizowanych przetwórców. Wiele jest zatem jeszcze do zrobienia, a nie stanowi pocieszenia fakt, że nie tylko w Polsce?
Obecnie nie mamy już wymówki, że brak jest miejsc, gdzie można zostawić zużyte ogniwa. Każda placówka prowadząca sprzedaż baterii oraz ich wymianę ma obowiązek przyjąć je od nas (podobnie jak dzieje się ze starym sprzętem RTV i AGD). Także w wielu sklepach i szkołach wystawione są pojemniki, do których możemy wrzucić ogniwa. Zatem nie "rozgrzeszajmy" się i nie wyrzucajmy zużytych baterii i akumulatorów do śmieci. Przy odrobinie chęci znajdziemy punkt zbiórki, a same ogniwa ważą tak niewiele, że odniesienie na pewno nas nie zmęczy.
Sortowanie
Podobnie jak w przypadku innych surowców wtórnych, efektywna przeróbka ma sens po uprzednim posortowaniu. Odpady pochodzące z zakładów produkcyjnych są zwykle jednorodne pod względem jakościowym, lecz te ze zbiórek publicznych stanowią mieszaninę dostępnych typów ogniw. Kluczowym zagadnieniem staje się więc segregacja.
W Polsce sortowanie odbywa się ręcznie, ale w innych krajach europejskich funkcjonują już zautomatyzowane linie sortownicze. Wykorzystywane są w nich sita o oczkach odpowiedniej wielkości (co umożliwia rozdzielenie ogniw o różnych gabarytach) oraz prześwietlanie promieniami X (sortowanie pod względem zawartości określonych związków chemicznych). Również skład surowca pochodzącego ze zbiórek w Polsce jest nieco odmienny.
Do niedawna dominowały u nas klasyczne kwasowe ogniwa Leclanchego. Dopiero ostatnio daje się zauważyć przewagę nowocześniejszych ogniw alkalicznych, które już wiele lat temu zdobyły rynki zachodnie. W każdym razie oba typy ogniw jednorazowych to ponad 90% zebranych baterii. Pozostałą część stanowią ogniwa guzikowe (zasilanie zegarków (rys. 3) czy kalkulatorów), ładowalne akumulatory oraz baterie litowe do telefonów i laptopów. Powodem tak małego ich udziału jest wyższa cena i dłuższy czas życia w porównaniu z ogniwami jednorazowymi.
Przerób
Po rozdzieleniu przychodzi czas na najważniejszy etap recyklingu - odzyskiwanie surowców. W przypadku każdego z typów nieco odmienne będą otrzymane produkty. Technologie przeróbki są jednak podobne.
Recykling mechaniczny polega na rozdrobnieniu odpadów w młynach. Powstałe frakcje rozdziela się wykorzystując elektromagnesy (żelazo i jego stopy) oraz specjalne układy sit (pozostałe metale, elementy z tworzyw sztucznych, papier itp.). Zaletą metody jest brak konieczności dokładnego sortowania surowca przed przerobem, wadą - duża ilość nieużytecznych odpadów, wymagających składowania na wysypiskach.
Recykling hydrometalurgiczny polega na rozpuszczeniu ogniw w kwasach lub zasadach. W następnym etapie przeróbki oczyszcza się powstałe roztwory oraz wydziela z nich potrzebne związki chemiczne, np. sole metali do otrzymania czystych pierwiastków. Dużą zaletą metody jest niska energochłonność oraz niewielkie ilości odpadów wymagających składowania. Wadą tego sposobu recyklingu jest konieczność dokładnego posortowania baterii w celu uniknięcia zanieczyszczenia powstających produktów.
Recykling termiczny polega na spaleniu ogniw w piecach o odpowiedniej konstrukcji. W efekcie otrzymuje się wytopione metale zawarte w bateriach oraz ich tlenki (surowiec dla hut). Zaletą metody jest możliwość użycia nieposortowanych baterii, wadą zaś - energochłonność oraz powstawanie szkodliwych produktów spalania.
Oprócz poddania recyklingowi ogniwa składuje się na wysypiskach po uprzednim zabezpieczeniu przed przenikaniem ich składników do środowiska. Jest to jednak tylko półśrodek, odwlekający w czasie konieczność zajęcia się tym rodzajem odpadów, a ponadto marnotrawstwo wielu cennych surowców.
Również w domowym laboratorium możemy odzyskać nieco użytecznych substancji. Są to składniki klasycznych ogniw Leclanchego - cynk o dużej czystości z otaczających ogniwo kubeczków oraz grafitowe elektrody. Ewentualnie wyizolować możemy jeszcze dwutlenek manganu z wypełniającej wnętrze mieszaniny - wystarczy zagotować ją z wodą (w celu usunięcia rozpuszczalnych domieszek, głównie chlorku amonu) i przesączyć. Nierozpuszczalna pozostałość (zanieczyszczona pyłem węglowym) będzie nadawać się do przeprowadzenia większości reakcji z udziałem MnO2.
Ale recyklingowi podlegają nie tylko ogniwa używane do zasilania domowego sprzętu. Źródłem surowców są również stare akumulatory samochodowe. Odzyskuje się z nich ołów, używany następnie do produkcji nowych urządzeń oraz utylizuje obudowy i wypełniający je elektrolit.
Nikomu nie trzeba przypominać, jakich spustoszeń w środowisku może dokonać toksyczny metal ciężki oraz roztwór kwasu siarkowego. Dla naszej szybko rozwijającej się cywilizacji technicznej przykład ogniw i akumulatorów jest modelowy. Coraz większym problemem staje się nie samo wyprodukowanie danego wyrobu, ale jego utylizacja po zużyciu. Mam nadzieję, że swym przykładem Czytelnicy "Młodego Technika" zachęcą do recyklingu również innych.
Doświadczenie 1 - ogniwo litowe
Ogniwa litowe używane są w kalkulatorach i do podtrzymywania zasilania BIOS-u płyt głównych komputerów (rys. 4). Potwierdzimy obecność w nich metalicznego litu.
Po demontażu ogniwa (np. często spotykanego typu CR2032) możemy obejrzeć szczegóły konstrukcji (rys. 5): czarną sprasowaną warstwę dwutlenku manganu MnO2, porowaty separator elektrod nasączony roztworem elektrolitu organicznego, izolujący pierścień z tworzywa sztucznego oraz dwie metalowe części tworzące obudowę.
Na mniejszą z nich (elektroda ujemna) naniesiona jest warstwa litu, szybko ciemniejąca na powietrzu. Pierwiastek identyfikujemy za pomocą próby płomieniowej. W tym celu na koniec drucika żelaznego nabieramy nieco miękkiego metalu i wprowadzamy próbkę do płomienia palnika - karminowe zabarwienie świadczy o obecności litu (rys. 6). Pozostałości metalu utylizujemy roztwarzając go w wodzie.
Metalową elektrodę z warstwą litu wkładamy do zlewki i wlewamy kilka cm3 wody. W naczyniu zachodzi energiczna reakcja, której towarzyszy wydzielanie gazowego wodoru:
Wodorotlenek litu jest mocną zasadą, co łatwo możemy sprawdzić za pomocą papierka wskaźnikowego.
Doświadczenie 2 - ogniwo alkaiczne
Rozcinamy jednorazowe ogniwo alkaliczne, np. typu LR6 ("paluszek", AA). Po otworzeniu metalowego kubeczka widoczna jest wewnętrzna struktura (rys. 7): w środku jasna masa tworząca anodę (wodorotlenek potasu lub sodu i pył cynkowy) oraz otaczająca ją ciemna warstwa dwutlenku manganu MnO2 z pyłem grafitowym (katoda ogniwa).
Elektrody odseparowane są od siebie papierową przeponą. Nieco jasnej substancji przenosimy na papierek wskaźnikowy i zwilżamy kroplą wody. Niebieskie zabarwienie świadczy o zasadowym odczynie masy anodowej. Rodzaj użytego wodorotlenku najłatwiej sprawdzić za pomocą próby płomieniowej. Próbkę wielkości kilku ziaren maku przyklejamy do zwilżonego wodą drucika żelaznego i wprowadzamy do płomienia palnika.
Żółte zabarwienie świadczy o zastosowaniu przez producenta wodorotlenku sodu, różowofioletowe - wodorotlenku potasu. Ponieważ związki sodu stanowią zanieczyszczenie praktycznie wszystkich substancji, a próba płomieniowa dla tego pierwiastka jest niezwykle czuła - żółta barwa płomienia może zamaskować linie widmowe potasu. Rozwiązaniem jest obejrzenie płomienia przez niebieskofioletowy filtr, którym może być szkło kobaltowe lub roztwór barwnika w kolbie (indygo lub fioletu metylowego występującego w środku do odkażania ran - pioktaninie). Filtr pochłonie żółtą barwę, umożliwiając potwierdzenie obecności potasu w próbce.
W celu ułatwienia identyfikacji rodzaju ogniw, wprowadzono specjalny kod liczbowo-literowy. Dla typów najczęściej spotykanych w naszych domach ma on postać: liczba-litera-litera-liczba, gdzie:
- pierwsza liczba oznacza liczbę ogniw; pomijana dla ogniw pojedynczych.
- pierwsza litera oznacza typ ogniwa. Gdy jej brak, mamy do czynienia z cynkowo-grafitowym ogniwem Leclanchego (anoda: cynk, elektrolit: chlorek amonu NH4Cl, chlorek cynku ZnCl2, katoda: dwutlenek manganu MnO2). Pozostałe typy ogniw oznacza się następująco (zamiast wodorotlenku potasu stosowany jest również tańszy wodorotlenek sodu):
A, P - ogniwa cynkowo-powietrzne (anoda: cynk, na grafitowej katodzie redukuje się tlen z powietrza);
B, C, E, F, G - ogniwa litowe (anoda: lit, natomiast jako katody oraz elektrolit stosowanych jest wiele substancji);
H - akumulator niklowo-wodorkowy Ni-MH (wodorek metalu, KOH, NiOOH);
K - akumulator niklowo-kadmowy Ni-Cd (kadm, KOH, NiOOH);
L - ogniwo alkaliczne (cynk, KOH, MnO2);
M - ogniwo rtęciowe (cynk, KOH; HgO), obecnie już nieużywane;
S - ogniwo srebrowe (cynk, KOH; Ag2O);
Z - ogniwo niklowo-manganowe (cynk, KOH, NiOOH, MnO2).
- kolejna litera oznacza kształt ogniwa:
F - płytkowe;
R - cylindryczne;
S - prostopadłościenne;
P - obecne oznaczenie ogniw o kształtach innych niż cylindryczne.
- końcowa liczba lub liczby oznaczają rozmiar ogniwa (wartości katalogowe lub wprost podające wymiary).
Przykłady oznaczeń:
R03 - ogniwo cynkowo-grafitowe o rozmiarach "małego paluszk"”. Inne oznaczenie to AAA lub micro.
LR6 - ogniwo alkaliczne o rozmiarach "paluszka". Inne oznaczenie to AA lub mignon.
HR14 -akumulator Ni-MH, jako oznaczenie rozmiaru stosuje się także literę C.
KR20 - akumulator Ni-Cd o rozmiarze oznaczanym również literą D.
3LR12 - płaska bateria o napięciu 4,5V, składająca się z trzech ogniw alkalicznych.
6F22 - bateria o napięciu 9V; sześć pojedynczych płaskich ogniw cynkowo-grafitowych jest zamkniętych w prostopadłościennej obudowie.
CR2032 - ogniwo litowo-manganowe (lit, elektrolit organiczny, MnO2) o średnicy 20 mm i grubości 3,2 mm.