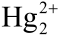Nieznany układ okresowy, część 2

Kuzyni po przekątnej
W pierwszej części artykułu przekonałeś się, że wodór tylko formalnie należy do grupy 1, czego dowodem m.in. fakt, że nazwa rodziny nie pochodzi od jego imienia (to jedyny taki przypadek w układzie okresowym). Jednak leżący pod nim lit także odstaje od reszty rodzeństwa (sód, potas, rubid, cez).
Zapewne wiesz, że wszystkie pospolite sole sodu i potasu są dobrze rozpuszczalne w wodzie. W analizie chemicznej identyfikuje się jony metali na podstawie tworzonych przez nie osadów, ale w przypadku sodu i potasu naprawdę trzeba się natrudzić, aby znaleźć takie, które jedynie słabo rozpuszczają się w wodzie. Z rubidem i cezem jest podobnie. Natomiast lit tworzy słabo rozpuszczalny węglan, fosforan czy fluorek.
Chemicy doszli do wniosku, że takie zachowanie upodabnia go do pierwiastków z grupy 2, a zwłaszcza magnezu. Z wykonaniem doświadczeń potwierdzających dostrzeżone podobieństwo nie powinieneś mieć żadnych problemów. Siarczan lub chlorek magnezu są łatwo dostępne, węglan i fosforan sodu również. W przypadku fluorków zaopatrz się w sól sodu, potasu lub amonu. O licie natomiast traktował artykuł z numeru 5/2020 "Młodego Technika", tam też możesz się dowiedzieć, jak domowym sposobem uzyskać jego związki (surowcem są ogniwa litowe (1)).
Czołowy pierwiastek grupy 2 - beryl - jest najbardziej podobny do glinu (w długiej formie tablicy Mendelejewa grupa 13 nie sąsiaduje z 2, ale rozpatrujemy podobieństwo między tzw. dużymi grupami: 1, 2, 13-18). Obydwa są amfoterycznymi metalami rozpuszczalnymi w kwasach i zasadach, podobnie jak ich wodorotlenki. O pozostałych berylowcach nie można tego powiedzieć.
Nie sądź jednak, że lit i beryl leżą w niewłaściwych miejscach tablicy Mendelejewa. Oba pierwiastki są silnie związane podobieństwem z resztą swoich rodzin, a pewna odrębność lidera grupy od pozostałych jej członków to jeszcze jedna osobliwość układu okresowego. Chemicy już w XIX wieku doszli do wniosku, że pierwszy pierwiastek grupy ma właściwości zbliżone do właściwości pierwiastków z następnej grupy, a zwłaszcza do leżącego na drugim miejscu, po przekątnej. Zaobserwowaną prawidłowość nazwali regułą diagonalnego podobieństwa (ang. diagonal = przekątna).
Bor, pierwszy pierwiastek z grupy 13, też nie jest w pełni podobny do następnych reprezentantów rodziny, np. glinu. Przede wszystkim w ogóle nie jest metalem i tworzy bardzo słabe kwasy borowe. Po stopieniu tlenku boru z tlenkami metali powstają szkliste substancje używane w analizie chemicznej (rodzaj metalu rozpoznaje się po zabarwieniu, jakie przyjmuje tzw. perła boraksowa). Pozostałe borowce tak się nie zachowują. Natomiast w grupie 14, po przekątnej w stosunku do boru, leży krzem. Ten pierwiastek również nie jest metalem, także tworzy liczne słabe kwasy krzemowe, a co do szkieł… wystarczy spojrzeć przez okno. Analogiczne podobieństwa można znaleźć i w innych grupach, np. tlen ze swoją reaktywnością jest podobny do chloru.
Zalety krótkiej formy
W podręcznikach i oficjalnych opracowaniach dominuje długa forma tablicy Mendelewa, pierwotnie opracowana przez szwajcarskiego chemika Alfreda Wernera, twórcę teorii związków kompleksowych. Dzieli ona przejrzyście pierwiastki na bloki energetyczne, ale zarazem sprawia, że niektóre aspekty prawa okresowości stają się niedostrzegalne.
Zacznij od eksperymentu. Przygotuj roztwory rozpuszczalnych soli ołowiu (azotan Pb(NO3)2 lub octan (CH3COO)2Pb) oraz baru (chlorek BaCl2 lub azotan Ba(NO3)2). Bądź ostrożny podczas eksperymentowania z tymi związkami, ponieważ są one trujące (czyli nosisz ochronne rękawice i oczywiście nie jesz i nie pijesz podczas pracy). Potrzebne ci będą jeszcze roztwory chromianu potasu K2CrO4 (też jest toksyczny) i rozpuszczalnego siarczanu, np. Na2SO4. Przeprowadź reakcje soli ołowiu z chromianem i siarczanem i tak samo postąp z solą baru. Próby wykonaj w probówkach lub - lepiej, ponieważ oszczędzasz odczynniki - na płytce porcelanowej z wgłębieniami używanej do reakcji kroplowych. Jeżeli nie masz takiej płytki, użyj blistra po tabletkach lub po prostu zmieszaj po kropli roztworów na folii.
W przypadku skali eksperymentu laboratoryjnego, chemicy już od dawna starają się być minimalistami, co stwarza mniejsze zagrożenie i pozwala na oszczędność czasu i kosztów pracy. Niezależnie od sposobu wykonania eksperymentów, w każdym z przypadków otrzymałeś osady: białe PbSO4 i BaSO4 oraz żółty PbCrO4 i jasnożółty BaCrO4 (2). Zachowanie obu anionów oraz wzory tworzonych przez nie soli są do siebie zbliżone, można jeszcze dodać, że wszystkie one były (sole ołowiu) lub nadal są (sole baru) stosowane jako pigmenty.
Pokrewieństwo chromu i siarki nie jest przypadkiem, a w układzie okresowym jest więcej takich analogii. Przypomnij sobie również (odcinek z ubiegłego miesiąca), że ołów z grupy 14 najchętniej przyjmuje wartościowość równą II, czyli taką, jaką ma bar z grupy 2. W dodatku często reaguje podobnie do cięższych berylowców, np. w jednym ze schematów analizy jakościowej wykrywany jest z wapniem, strontem i barem na podstawie tworzenia trudno rozpuszczalnych siarczanów.
(z prawej – ciemne tło ułatwia obserwację jasnych osadów).
Chrom znajduje się w grupie 6, natomiast siarka - w 16. Dzieli je zatem dość duża odległość, ale tylko w długiej formie tablicy. Forma krótka, której autorem jest sam Mendelejew (3), łączy obie te grupy w jedną rodzinę podzieloną na dwa "klany": grupę główną oznaczoną symbolem VIA (grupa 16 z formy długiej) i grupę poboczną VIB (grupa 6).
Analogicznie jest i z innymi rodzinami: grupa I składa się z grupy 1 połączonej z 11, II - z 2 oraz 12, itd. Ponieważ jest 8 "dużych" grup (1, 2, 13-18) i 10 "małych" (3-12), pojawił się problem z połączeniem grup 8, 9 i 10 z 18 (nie istniał on w czasach Mendlejewa, ponieważ helowce zostały odkryte dopiero w końcu XIX wieku). Chemicy od dawna zauważyli szczególne podobieństwo właściwości występujące między sąsiadującymi pierwiastkami z tych grup i w ten sposób VIII grupa poboczna składa się z trójek pierwiastków - tzw. triad: żelazowców (Fe, Co, Ni), platynowców lekkich (Ru, Rh, Pd) i platynowców ciężkich (Os, Ir, Pt) (4). Helowce początkowo uznawano za grupę zerową, ostatecznie przydzielono je do grupy VIII, ale oczywiście dopatrywanie się jakichkolwiek podobieństw gazów szlachetnych do innych pierwiastków jest bezcelowe.
Molibden i wolfram, pozostałe pierwiastki z grupy VI pobocznej, podobnie jak chrom wykazują podobieństwo do siarki i tworzą analogiczne sole, np. BaMoO4 (molibdenian) i BaWO4 (wolframian). Ponadto chromiany, molibdeniany i wolframiany chętnie polimeryzują, tworząc kwasy o bardziej złożonej strukturze. Przykładem soli takiego kwasu jest powszechny w laboratoriach dwuchromian potasu K2Cr2O7. A siarka? Grono tworzonych przez nią kwasów jest równie liczne (niektóre nie istnieją w stanie wolnym, a jedynie jako sole), czego przykładem analog dwuchromianu - pirosiarczan potasu K2S2O7. Podobieństwo siarki z chromowcami nie jest jednak całkowite (np. Ag2SO4 jest rozpuszczalny w wodzie, natomiast Ag2CrO4 tworzy brunatnoczerwony osad), dotyczy tylko najwyższej osiągalnej wartościowości - VI, na niższych analogia zanika.
A jak jest w innych grupach? Wanadowce tworzą sole kwasów podobnych do wywodzących się z fosforu (H3PO4, HPO3), np. wanadany Na3VO4 lub NH4VO3. W grupie VII (7 i 17 w formie długiej) analogia jest jeszcze wyraźniejsza. Dwa popularne związki potasu - nadmanganian KMnO4 i nadchloran KClO4 - tak się do siebie upodobniły, że powstają nawet kryształy mieszane w dowolnych proporcjach. W takim przypadku mówimy, że związki wykazują izomorfizm (z gr. isos = ta sama, morphe = postać), czyli tworzą kryształy o takiej samej strukturze, a wielkość jonów pozwala na wzajemne zastępowanie się w sieci krystalicznej. Oba związki są też utleniaczami i oba stosunkowo słabo rozpuszczają się w wodzie (5).
W innych grupach również można dostrzec podobieństwo: skandowce (grupa 3) zbliżają się właściwościami do glinu, a tytanowce (grupa 4) do cyny. Cynk i kadm (grupa 12) to pierwiastki reagujące podobnie do magnezu (ten ostatni nie jest oczywiście amfoteryczny).
Podobieństwa natomiast nie dostrzeżesz w grupie I. Najmniej szlachetne metale, litowce, nie mają nic wspólnego z królewską rodziną 11 (miedź, srebro i złoto). W tym przypadku wnioskowanie na podstawie położenia w krótkiej formie tablicy sprowadzi cię na chemiczne manowce.
Piękna i groźna
W odcinku z ubiegłego miesiąca dowiedziałeś się, że wodór tylko formalnie należy do grupy 1, ale prawie żadne właściwości (poza wartościowością) nie wiążą go z niżej leżącymi pierwiastkami. W układzie okresowym istnieje jeszcze jeden pierwiastek znacznie odbiegający od reszty rodziny - tytułowa groźna piękność, czyli rtęć. Ciekły metal od chwili odkrycia fascynował ludzi, nieświadomych jeszcze wtedy jego zabójczego działania.
Rtęć należy do grupy 12, w jej przypadku maksymalna wartościowość wynosi II i takie związki istnieją. Srebrzysta ciecz jednak niechętnie dzieli się elektronami, czego dowodem ciekły stan skupienia i niska temperatura wrzenia. W stanie pary występuje jako pojedyncze atomy, a dwa nieaktywne elektrony na zewnętrznej powłoce najbardziej upodabniają rtęć do …helu (6). Utrata jednego z elektronów powoduje, że ma ona konfigurację podobną do wodoru i, tak jak wodór, tworzy cząsteczki dwuatomowe - unikatowe w całym układzie okresowym jony
Rtęć również zdaje się leżeć w niewłaściwym miejscu tablicy Mendelejewa.
Krzysztof Orliński