Nieznany układ okresowy, część 1
Prawo okresowości i utworzona na jego podstawie tablica układu okresowego pierwiastków to bez wątpienia jedno z największych osiągnięć nauki. Pozwoliło ono uporządkować wiedzę o "cegiełkach" budujących nasz świat i znalazło zastosowanie nie tylko w chemii, ale i fizyce, biologii, geologii i wielu innych dziedzinach. Słusznie zatem trafiło do szkolnych programów. Jednak …
…szkolny obraz …
…jest uproszczony, ponieważ taki być musi w początkowym etapie edukacji. Sto osiemnaście pierwiastków podzielonych na 7 okresów i 18 grup (w długiej wersji tablicy układu okresowego). Pod całością wyodrębnia się dwa szeregi po 14 lub 15 pierwiastków, nominalnie należących do grupy 3. To lantanowce i aktynowce, ale o nich więcej przeczytasz później. Z położenia pierwiastków w układzie okresowym wynika szereg reguł, które są treścią zadań na twoich sprawdzianach z chemii (1).
Na przykład: rozmiary atomów maleją w obrębie okresu (od lewej do prawej) i rosną przy przechodzeniu w dół grupy, a każdy okres zaczyna się aktywnym metalem i kończy aktywnym niemetalem oraz gazem szlachetnym. Gdy jednak wyjdziesz poza szkolne podręczniki, okaże się, że reguły, których się uczyłeś, są wręcz naszpikowane wyjątkami. Ale jedna z nich jest niepodważalna: o wszystkich właściwościach pierwiastka …
…decyduje konfiguracja …
…elektronowa, czyli rozmieszczenie elektronów na powłokach wokół jądra jego atomu. Szczególną rolę odgrywają elektrony walencyjne, czyli te, przy pomocy których atom styka się ze światem zewnętrznym. Przy czym słowo "styka" nie należy rozumieć dosłownie: wcale nie muszą to być tylko elektrony położone na zewnętrznej powłoce, często mieszczą się one w głębszych warstwach, ale w atomie mają największe energie. To jeszcze jeden przypadek, gdy wyobrażenia wyniesione ze świata, który nas otacza, nie przystają do praw rządzących mikroświatem.
Numer okresu, w którym leży dany pierwiastek określa również liczbę jego powłok elektronowych. I od tej reguły jest wyjątek: pallad położony w okresie 5 ma tylko cztery powłoki. O tym fakcie przesądziło "lenistwo" natury, która dąży do minimalizacji energii układu. W przypadku palladu korzystniejsze jest przeniesienie elektronów do niższej powłoki (ma ona określoną pojemność, zatem pomieści tylko ich ograniczoną liczbę), ale i inne pierwiastki zmieniają porządek rozmieszczania elektronów (określoną kolejnymi regułami), dzięki czemu i ich atomy mają niższe energie.
W bardziej szczegółowym ujęciu powłoki dzielą się na podpowłoki (jeśli wyobrazisz sobie przekrój atomu jako pień ściętego drzewa, powłokom odpowiadają słoje rocznych przyrostów, natomiast podpowłokom - słoje przyrostów dziennych, możliwe do zaobserwowania w obrębie powłok pod mikroskopem). Podział na podpowłoki dobrze obrazuje długa forma tablicy: podpowłoka s to grupy 1 i 2 (plus hel), p - to grupy od 13 do 18, d - grupy od 3 do 12, natomiast f - lantanowce i aktynowce.
Oczywiście i tu zdarzają się liczne wyjątki - pierwiastki należące do danego bloku energetycznego często nie posiadają elektronów, które powinny mieć ze względu na swoją przynależność (przeniosły je, aby zmniejszyć energię atomu) (2).
Wodorowy problem
Najlżejszy gaz w układzie okresowym znajduje się w grupie …litowców. Jeżeli wiesz, że nazwy grup pochodzą od imienia pierwszego pierwiastka w grupie, powinieneś już przeczuć, że z wodorem jest "coś nie tak". Rzeczywiście: gaz w jednej grupie z typowymi metalami? Co prawda wiąże je wartościowość - dla wszystkich pierwiastków z grupy litowców wynosi I (3). Ale to jedyne podobieństwo wodoru do pozostałych "krewnych".
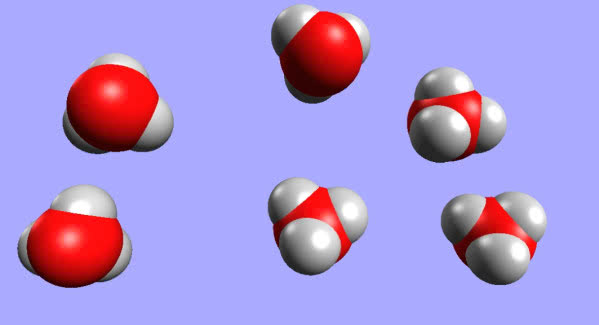
Być może zaprzeczysz, twierdząc, że zarówno litowce, jak i wodór tworzą jony w roztworze wodnym: H+, Li+, Na+, itd. To jednak kolejny przybliżony obraz. Jon wodorowy jest naprawdę tylko "gołym" protonem, cząstką dziesiątki tysięcy razy mniejszą niż inne jony. W takiej postaci nie może istnieć w roztworze wodnym, wobec czego łączy się z cząsteczką wody, tworząc kation H3O+, twór już o "właściwych" rozmiarach, porównywalnych z innymi jonami (forma H+ stanowi tylko uproszczenie w zapisie równań reakcji) (4).
U pozostałych litowców nic takiego nie ma miejsca. Wodór tworzy jednak "normalne" jony, nie są one trwałe w wodzie, ale związki je zawierające można (chronione przed wilgocią) dowolnie długo przechowywać w postaci kryształów. Przykład jest dość spektakularny: wodorek sodu NaH, o strukturze krystalicznej dokładnie takie samej, jaką ma NaCl, zwykła sól kuchenna. Wodór występuje w niej w postaci anionu H-, podobnie jak chlor w postaci Cl- w chlorku sodu. Czyżby wodór był fluorowcem?
Elektroujemność to zdolność pierwiastka do przyłączania elektronów. Jej wartość zbliża wodór do węglowców - pierwiastków o elektroujemności pośredniej między fluorowcami chętnie przyłączającymi elektrony (wysoka elektroujemność) i łatwo je oddającymi litowcami (elektroujemność niska).
Zatem litowiec, fluorowiec czy węglowiec? W przypadku wodoru odpowiedź nie jest możliwa. To wyjątkowy pierwiastek, nie pasujący tak naprawdę do żadnej z grup układu. Tego samego zdania są autorzy podręczników chemii, opisując wodór oddzielnie od innych pierwiastków. Dlaczego zatem grupa 1? "Postawiono" na wartościowość wodoru, zresztą trzeba go było gdzieś umieścić w tablicy Mendelejewa.
Kłopoty z wartościowością
Ustalanie wartościowości pierwiastka na podstawie jego położenia w układzie okresowym to jedno z ulubionych pytań nauczycieli chemii. Szkolna reguła jest prosta: dla grup o numerach jednocyfrowych maksymalna wartościowość pierwiastka jest równa numerowi grupy, w której się znajduje, a dla grup o numerach większych od 10 - jest to cyfra jedności w numerze. Oczywiście z zastrzeżeniami: helowce z grupy 18 są "zerowartościowe" (choć otrzymano już związki ksenonu, w których posiada on maksymalną wartościowość równą … tak, zgadłeś - osiem. Czyli reguła jest prawdziwa.), a w przypadku pierwiastków z grupy 9 i 10 sięga co najwyżej VI. Jednak "ślepe" zawierzenie regule szybko sprowadzi cię na manowce.
Prawidłowość dobrze sprawdza się w przypadku grup od 1 do 7 i od 12 do 15. W tych przypadkach rzeczywiście maksymalne wartościowości są zgodne z podaną wcześniej zasadą (odpowiednio od I do VII i od II do V). W przypadku grupy 16 (tlenowce) i 17 (fluorowce) regułę spełniają pierwiastki leżące niżej, natomiast tlen (maksymalna wartościowość wynosi II) i fluor (tylko I) - nie. Podobnie żelazo z grupy 8 ma najczęściej wartościowość II i III, a tylko wyjątkowo VI. Czołowe pierwiastki wielu grup odbiegają jednak nieco swymi właściwościami do reszty rodzeństwa, co także jest jedną z osobliwości układu okresowego, ale o tym więcej w następnym odcinku.
Maksymalna wartościowość w danej grupie, nie oznacza, że wszystkie pierwiastki z rodziny równie chętnie ją przyjmują. Zwłaszcza najcięższe często "lenią" się z przekazaniem wszystkich dostępnych elektronów do utworzenia wiązań. I tak: tal z grupy 13 najczęściej ma wartościowość I, ołów z 14 - II, bizmut z 15 - III, a promieniotwórczy polon z 16 - IV. Istnieją również związki tych pierwiastków o maksymalnej możliwej wartościowości, ale są one nietrwałe.
Najdziwniejsze rzeczy z wartościowością dzieją się w królewskiej rodzinie, czyli grupie 11. Miedziowce, jak rzadko które metale (pomijając żelazo) wpłynęły na los świata, słusznie zatem należy się im to zaszczytne miano. Ze srebrem jest właściwie wszystko w porządku - ma wartościowość równą I (jeśli pominiemy bardzo nietrwałe i nieliczne połączenia srebra dwuwartościowego). Ale już miedź zwykle jest dwuwartościowa, a związki miedzi(I) są mniej trwałe.
Za to króla metali żadne reguły nie obowiązują. Najtrwalsza wartościowość złota wynosi III (połączenia jednowartościowe są mniej trwałe), lecz spotyka się również związki złota(V), a nawet złota(VII). Jakby tego było mało, stop złota z najaktywniejszym metalem - cezem - ma wszelkie właściwości …soli. Występują w niej kationy Cs+ (tego akurat można było się spodziewać) oraz aniony Au-. Związek CsAu nazywany jest złotkiem lub też aurydkiem (od łacińskiej nazwy króla metali) cezu. Czy wartościowości złota przypominają ci te, które występują u innych pierwiastków? Jeżeli pomyślałeś o chlorze, gratuluję wiedzy chemicznej i spostrzegawczości! Czyżby złoto było "zakamuflowanym" fluorowcem? W każdym razie szkolna reguła wyznaczania wartościowości w przypadku miedziowców zupełnie się nie sprawdza (5).
Jaka tablica?
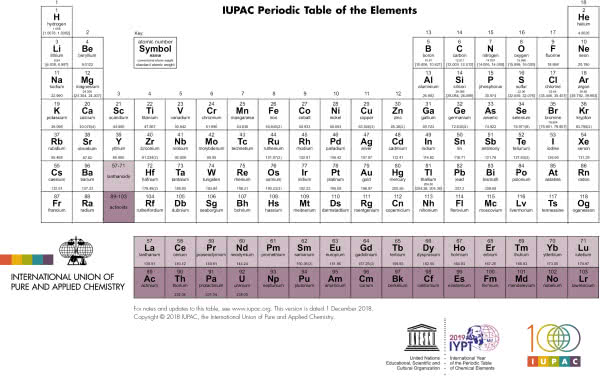
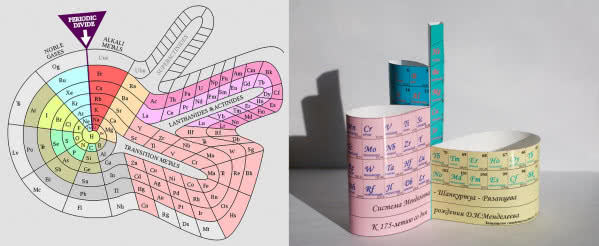
Nie istnieje jeden obowiązujący wzorzec tablicy układu okresowego. Organizacja zrzeszająca chemików, IUPAC (ang. International Union of Pure and Applied Chemistry, czyli Międzynarodowa Unia Chemii Czystej i Stosowanej), publikuje swój układ okresowy, ale tylko zaleca jego stosowanie. W ciągu już ponad 150 lat od opracowania pierwszej wersji przez Mendelejewa, powstało szereg różnych form przedstawienia prawa okresowości (6). Niektóre z nich lepiej nadają się do zaprezentowania wybranych właściwości, a są i takie, które przybierają przestrzenne, wręcz artystyczne formy. Może i ty spróbujesz skonstruować swój układ okresowy?
Prawo okresowości …
…w obecnej postaci brzmi: Właściwości pierwiastków chemicznych uporządkowanych zgodnie ze wzrastającą liczbą atomową powtarzają się okresowo. W oryginalnym sformułowaniu z roku 1869 kryterium porządkującym była masa atomowa (lub - jak wtedy mówiono - ciężar atomowy). Na szczęście dla Mendelejewa masa atomowa jest na ogół proporcjonalna do liczby atomowej (liczby protonów w jądrze pierwiastka), dzięki czemu mógł on ułożyć "chemicznego pasjansa" (7).
W połowie XIX wieku istniały tylko dwie nieprawidłowe pary, czyli dwa sąsiadujące pierwiastki, z których posiadający większą masę atomową był położony w układzie przed lżejszym od niego (kobalt i nikiel oraz tellur i jod). Mendelejew uważał, że masy atomowe są błędnie wyznaczone i rozmieścił pierwiastki zgodnie z ich właściwościami chemicznymi (licznie podejmowane w następnych latach próby korekty mas atomowych nieprawidłowych par nie przyniosły rezultatu). W końcu stulecia pojawiła się trzecia z nieprawidłowych par: argon i potas. Po odkryciu budowy jądra atomowego okazało się, że decyzja Mendlejewa była słuszna.
Krzysztof Orliński