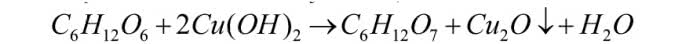Królewska rodzina. Królowa jest jedna (miedź) - część 2
Był to chlorkowy kompleks żółtej - co prawda - barwy, ale łatwo wyjaśnić powstawanie zieleni. W wielu doświadczeniach z dzisiejszego artykułu również wystąpią połączenia kompleksowe. Na początek …
…miedź w kleszczach.
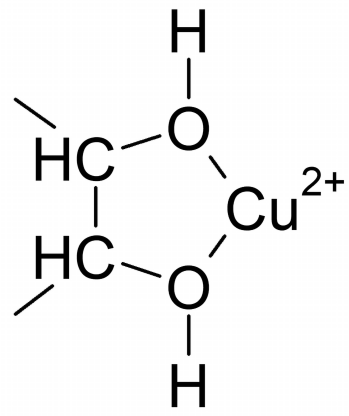
Zacznij od eksperymentu. Sporządź roztwór siarczanu( VI) miedzi(II) CuSO4, a dodatkowo roztwory wodorotlenku sodu NaOH, glukozy (kupisz ją w sklepie spożywczym), gliceryny (apteka) i glicyny (kwas aminooctowy, suplement diety). Do trzech probówek wlej roztwór CuSO4, a następnie roztwór NaOH. Od razu wytrąci się osad Cu(OH)2. Teraz do każdej z probówek dodaj nieco roztworu związku organicznego. W każdym z przypadków osad rozpuścił się, a zawartość naczynia zabarwiła na szafirowo (1).
Ten kolor to oznaka pojawienia się chelatowych kompleksów miedzi. Nazwa pochodzi od greckiego słowa chele oznaczającego szczypce raka. Podobnie jak wodny skorupiak, cząsteczka związku organicznego chwyta jon miedzi dwoma wiązaniami. W przypadku gliceryny i glukozy będą to dwie sąsiadujące grupy OH:
Związki łączące się z jonami metali przy pomocy kilku wiązań (nawet sześciu) spełniają ważną rolę biologiczną, umożliwiając ich transport przez błony komórkowe (w świecie organizmów żywych jony metali występują zazwyczaj jako składniki kompleksów chelatowych). Również chemicy często korzystają z tej klasy związków, np. w analityce do wykrywania i ilościowego oznaczania jonów metali.
Miedzi tlenki dwa
Pamiętasz reakcję CuSO4 z jodkiem potasu, w której ujawniły się utleniające właściwości miedzi(II)? Są one często wykorzystywane w chemii organicznej. Do wykrywania związków o charakterze redukującym służy próba Trommera, nazwana tak od nazwiska chemika, który ją opracował - Karla Augusta Trommera.
Do jej przeprowadzenia potrzebne będą roztwory CuSO4, NaOH i glukozy. Do probówki z roztworem soli miedzi dodaj roztwór wodorotlenku sodu, co spowoduje znaną ci już rekcję - wytrącenie błękitnego osadu Cu(OH)2. Teraz dolej roztwór glukozy - zawartość probówki przybiera szafirowe zabarwienie (już je widziałeś w jednym z poprzednich doświadczeń). Ogrzej naczynie nad płomieniem palnika lub w łaźni wodnej, czyli większej zlewce wypełnionej gorącą wodą. Zawartość zmienia barwę na pomarańczową, a następnie zaczyna wydzielać się ceglasty osad (2):
Miedź(II) w wyniku redukcji utworzyła tlenek metalu jednowartościowego, jednocześnie utleniając glukozę do kwasu glukonowego (właściwie glukonianu sodu, który powstał w zasadowym środowisku reakcji). Pomarańczowe zabarwienie oznacza dodatni wynik próby i potwierdza obecność związków o charakterze redukującym, np. aldehydów (do nich należy glukoza). Próba Trommera doczekała się kilku modyfikacji, np. w próbie Fehlinga używa się soli kwasu winowego, a w próbie Benedicta - soli kwasu cytrynowego. Ich zadaniem jest przekształcenie Cu(OH)2 w rozpuszczalne kompleksy, które są bardziej reaktywne niż sam wodorotlenek.
Powtórz próbę, ale tym razem zamiast glukozy dodaj roztwór sacharozy, czyli zwykłego cukru. Po ogrzaniu probówki nie zauważysz pomarańczowego zabarwienia, wytrącił się za to czarny osad. Jest to tlenek miedzi(II) CuO powstający w wyniku rozkładu wodorotlenku (3):
Cu(OH)2→CuO + H2O
Negatywny wynik próby (a taki zaobserwowałeś) oznacza, że badany związek nie jest reduktorem. Sacharoza, mimo, że składa się z glukozy i fruktozy - cukrów dających wynik pozytywny, sama nie ma takich własności. Połączenie glukozy i fruktozy powoduje blokadę grup odpowiedzialnych za właściwości redukujące.
Miedź jest mikroelementem, niezbędnym m.in. w procesie tworzenia czerwonych krwinek. Jej niedobór jest przyczyną anemii, ponieważ niedostatek miedzi upośledza zdolność przyswajania żelaza. Najważniejsze źródła miedzi to wątroba, zielone warzywa, ryby, pełne ziarna zbóż i nasiona roślin strączkowych. W krwi mięczaków i stawonogów miedź pełni taką samą rolę, jak żelazo w naszej. Arystokratyczne pochodzenie miedzi zapewnia ślimakom i rakom - dosłownie - błękitną krew! Równocześnie miedź jest toksyczna dla drobnoustrojów. Z tego powodu instalacje w przemyśle spożywczym często wykonywane są z miedzi. Związków miedzi używa się jako preparatów grzybobójczych i odkażających wodę (np. w akwariach). CuSO4 wchodzi w skład zestawów ratunkowych dla rozbitków, ponieważ odstrasza rekiny. Wśród bakterii istnieją jednak i takie, którym "smakują" związki miedzi. Nieopłacalne w eksploatacji wyrobiska kopalń oraz hałdy zalewa się wodą z odpowiednio dobranymi szczepami, a po pewnym czasie powstaje gotowy roztwór związków miedzi. Z niego można już łatwo otrzymać metal, praktycznie za darmo. Może taka jest przyszłość górnictwa i metalurgii?
Żarłoczny chlorek
U progu XX wieku miedź została utraciła drugie miejsce pod względem wielkości produkcji wśród metali na rzecz aluminium. Jednak jest reakcja, w której miedź potrafi się odgryźć pospolitemu pierwiastkowi, i to dosłownie. Do reakcji potrzebny będzie chlorek miedzi(II) CuCl2 oraz folia aluminiowa do pakowania produktów spożywczych. Jeśli nie masz chlorku, pozostaje wytworzyć go samodzielnie. W tym celu wytrąć osad Cu(OH)2, ale nie odsączaj go (bardzo trudno sączy się galaretowate osady). Ogrzej naczynie, aż osad się rozłoży. Odsącz tlenek, przemyj go wodą i rozpuść w jak najmniejszej ilości kwasu solnego. Możesz odparować roztwór.
Na tacy postaw zlewkę i wlej do niej 5-10% roztwór CuCl2. Do zlewki włóż zwinięty w rulon kawałek folii aluminiowej. Nie da się nie zauważyć oznak gwałtownie przebiegającej reakcji: folia aluminiowa szybko znika, jest wręcz "pożerana" przez ciecz w naczyniu, a roztwór zaczyna wrzeć. Po zużyciu kawałka folii możesz włożyć następny jej fragment. I tym razem proces zachodzi bardzo szybko, a w naczyniu zamiast aluminium wkrótce pojawia się czerwonobrunatny osad metalicznej miedzi (4).
Królowa wzięła odwet, ale jakie procesy przebiegały w zlewce? Na pewno zauważyłeś wypieranie miedzi z roztworu przez bardziej reaktywny glin:
3Cu2++ 2Al→3Cu ↓ + 2Al3+
Jednak ta reakcja nie zaszłaby tak łatwo z powodu istnienia na powierzchni glinu szczelnej warstwy tlenku (to dzięki niej aluminium nie koroduje na powietrzu i może być używane jako metal konstrukcyjny). Chlorek miedzi(II) powoduje wzrost zakwaszenia roztworu (sól mocnego kwasu i słabej zasady), co pozwala usunąć ochronną warstwę z powierzchni metalu:
Al2O3 + 2Al → 2Al3+ + 3H2O
Odsłonięta powierzchnia metalicznego glinu reaguje również z wodą:
2Al + 6H2O → 2Al(OH)3 + 3H2 ↑
Ostatni proces przebiega z wydzieleniem dużych ilości ciepła, co sprawia, że roztwór wrze. Tak właśnie zachowywałby się glin, gdyby nie ochronna warstwa na jego powierzchni.
Demakijaż
Królowa metali lubi upiększać swe oblicze. Prawdziwy kolor miedzi jest więc inny niż go widzimy. Miedzianą barwę powoduje obecność powłoki Cu2O, która tworzy się na powierzchni metalu w obecności powietrza. Aby dowiedzieć się, jaka jest naprawdę barwa miedzi, musisz przeprowadzić chemiczny demakijaż.
Doświadczenie może stanowić zagrożenie w przypadku niedbałego podejścia do jego wykonania. Dlatego też zastosuj się ściśle do podanych zasad bezpieczeństwa. Eksperymentuj na niepalnym podłożu, ponadto w pobliżu nie mogą się znajdować żadne palne przedmioty, a pod ręką miej podręczne środki gaśnicze, np. stary koc do stłumienia ognia.
Potrzebna ci będzie cienka blaszka miedziana oraz aceton. Rozpuszczalnik wlej do wysokiego i wąskiego słoika w takiej ilości, aby na dnie utworzyła się około centymetrowej grubości warstwa. Przykryte naczynie umieść w ciepłym miejscu - w reakcji biorą udział pary acetonu, ale wrze on w temperaturze 56°C, więc opary szybko wypełnią słoik.
Blaszkę przetrzyj wacikiem zwilżonym acetonem w celu odtłuszczenia i umocuj do zakrętki słoika za pomocą drutu o takiej długości, aby koniec metalu znalazł się w odległości kilku milimetrów od warstwy acetonu. Trzymaj blaszkę w płomieniu palnika, aż rozgrzeje się do czerwoności. Pamiętaj, że słoik z acetonem musi znajdować się w odległości co najmniej jednego metra od otwartego ognia! Wyjmij blaszkę z płomienia i umieść ją w słoiku. Podczas przenoszenia zauważysz, że metal pokrył się czarną warstwą CuO (5). Blaszka w naczyniu jednak szybko zmienia barwę: czarny kolor znika, a w jego miejsce pojawia się róż (taki jest więc prawdziwy kolor miedzi) (6). W zaciemnionym pomieszczeniu zaobserwujesz świecenie rozgrzanej blaszki.
Siłą napędową reakcji jest utlenianie acetonu przy pomocy tlenku miedzi(II), a i sama miedź również katalizuje ten proces. CuO często używa się w chemii organicznej jako środka dostarczającego tlenu.
Wenus i Mars
Miedź, którą alchemicy skojarzyli z planetą Wenus i żelazo, metal Marsa, często występują razem. Dla jonów obu metali istnieją próby charakterystyczne, ale w mieszaninie ich wyniki nie zawsze są jednoznaczne (np. barwa osadu jednego jest maskowana przez kolor drugiego). Istnieją jednak metody umożliwiające identyfikację składników nawet złożonej mieszaniny. Najprostszą z nich jest analiza kroplowa (bo tyle tylko odczynników potrzeba) na bibule filtracyjnej. Przygotuj kawałki bibuły np. z pociętego sączka i roztwory: CuSO4, FeCl3, mieszaniny obu soli oraz amoniaku.
Na bibułę nanieś kilka kropli roztworu amoniaku, a następnie soli miedzi. Powstaje niebieska plama (przypomnij sobie reakcje charakterystyczne dla miedzi z poprzedniego odcinka). Na drugi fragment bibuły nanieś roztwór amoniak i kroplę roztworu soli żelaza(III). Tym razem plama będzie w kolorze brunatnym (utworzył się wodorotlenek). Oba kawałki bibuły stanowią wzorce. Na trzeci fragment również nanieś roztwór amoniaku, a następnie kroplę mieszaniny soli miedzi i żelaza. Po chwili zauważysz, że w środku znajduje się ciemny obszar (żelazo), natomiast na zewnątrz pojawia się niebieskie zabarwienie pochodzące od związku miedzi (7). Dzięki istnieniu dużej liczby kapilarnych kanałów w bibule, woda szybko się rozprzestrzenia ciągnąc za sobą powstające barwne substancje. Migrują one jednak z różną szybkością, co umożliwia ich rozdzielenie i zaobserwowanie indywidualnych kolorów.
Jony obu metali reagują również z K4[Fe(CN)6] (żelazo tworzy tzw. błękit pruski). Wykonanie próby, analogicznie jak z roztworem amoniaku, pozostawiam tobie. Czy uda ci się rozpoznać ślady związków miedzi i żelaza na bibule?
Krzysztof Orliński