Nieznany układ okresowy, część 3

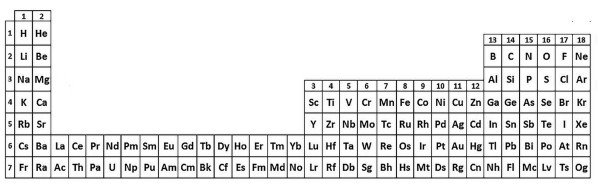
Lantanowce i aktynowce, dwa szeregi umieszczone zwykle pod spodem tablicy, w szkole traktowane są po macoszemu - ot, nauczyciel wspomni tylko o ich istnieniu i przejdzie do innych, "ważniejszych" pierwiastków. Zupełnie nieadekwatnie do funkcji, którą pełnią we współczesnym świecie. Uran i pluton (a niebawem i tor) stanowią podstawę energetyki jądrowej: źródło pewne w każdych warunkach klimatycznych (w przeciwieństwie do energetyki niekonwencjonalnej), a przy właściwym użytkowaniu - bezpieczne i przyjazne dla środowiska. Lantanowce zaś to obecnie surowce strategiczne, niezbędne w wielu zaawansowanych technologiach, np. bez lantanowców nie istniałaby współczesna elektronika. Ale nawet teraz obie grupy stanowią twardy orzech do zgryzienia dla prawa okresowości.
Problem numer 1: lantanowce
Mendelejew znał tylko kilka lantanowców i bez większych trudności udało mu się je umieścić w tablicy (1). Jednak w następnych latach odkrycia podobnych do siebie metali zakwestionowały samo prawo okresowości. Wymaga ono, aby kolejno następujące po sobie pierwiastki leżały w sąsiednich grupach i miały różne wartościowości. Tymczasem lantanowce o niewiele różniących się masach atomowych (co powodowało, że musiały stać jeden za drugim w nieprzerwanym szeregu) miały zawsze wartościowość równą III (niektóre również II albo IV), czyli znajdowały się w jednej grupie. Wysuwano liczne teorie na temat lantanowców, np. uważano je wszystkie za ten sam pierwiastek w różnych odmianach. Z problemu wybrnięto, umieszczając lantanowce w jednej "kratce" układu, ale dopiero mechanika kwantowa w latach 20.- i 30. XX wieku wyjaśniła ich położenie w układzie okresowym.
 1. Cer, najbardziej rozpowszechniony lantanowiec. Wszystkie pozostałe lantanowce są podobne, a ich wygląd przypomina aluminium (https://images-of-elements.com)
1. Cer, najbardziej rozpowszechniony lantanowiec. Wszystkie pozostałe lantanowce są podobne, a ich wygląd przypomina aluminium (https://images-of-elements.com)Z lantanowcami problem jest jednak do dziś. Właściwie nie wiadomo, od którego pierwiastka się zaczynają i na którym kończą. Według większości podręczników, lantan, choć dał nazwę całej rodzinie, do niej nie należy - jest skandowcem z grupy 3, a lantanowce to metale od ceru do lutetu. Jednak konkurencyjne opinie wskazują, że znacznie lepszym skandowcem jest ostatni z rodziny - lutet. Jego właściwości fizyczne i chemiczny charakter tworzonych związków lepiej pasują do cech pozostałych pierwiastków grupy 3 (tym sposobem lantanowce to metale od lantanu do iterbu). Dyskusje między chemikami trwają nadal, natomiast autorzy książek w różny sposób prezentują położenie tych pierwiastków (2).
Problem nr 2: aktynowce
Aktynowce, czyli pierwiastki od aktynu do lorensu, stanowią grupę analogiczną do lantanowców, umieszczoną w następnym okresie. Problem z aktynowcami był i nadal jest taki sam, jak w przypadku lantanowców. Mendelejew znał tylko dwa aktynowce i nie miał kłopotów z umieszczeniem ich w tablicy (3). Tor z najtrwalszą wartościowością IV trafił do grupy z tytanem i cyrkonem, natomiast VI-wartościowy uran znalazł się w towarzystwie chromu, molibdenu i wolframu.
Odkrycia z przełomu XIX i XX wieku zachwiały układem: pojawiło się kilkanaście pierwiastków promieniotwórczych. Niektóre z nich miały te same masy, ale różne właściwości, inne zaś o jednakowych właściwościach - różne masy. Fakt ten był sprzeczny z dotychczasową wiedzą, lecz odkrycie izotopów wyjaśniło niektóre problemy. Większość pierwiastków okazała się mieszaninami atomów o różnych masach (ale oczywiście jednakowej liczbie protonów w jądrze). Wracając zaś do aktynowców: na początku ubiegłego wieku pojawiły się dwa z nich. Aktyn od razu wydał się podobny do lantanu (jego promieniotwórczość stwierdzano w osadach lantanowców wytrącanych z roztworów zawierających aktyn), natomiast protaktyn trafił do grupy z wanadem, niobem i tantalem jako pierwiastek V-wartościowy. Do lat 40. cztery pierwsze aktynowce leżały spokojnie w grupach od 3 do 6.
Problem pojawił się podczas realizacji Projektu "Manhattan". Fizycy i chemicy byli pewni, że wyprodukowali pierwiastki cięższe od uranu, jednak nie potrafili wykryć ich obecności metodami chemicznymi. Przykładowo: pierwiastek 93, kolejny po uranie, wcale nie zachowywał się jak przedstawiciel grupy 7. Dopiero sugestia Glena Seaborga, późniejszego odkrywcy kilku transuranowców, że pierwiastki począwszy od aktynu, tworzą szereg analogiczny do lantanowców, rozwiązała problem (4). Zastosowanie zaś metod opracowanych do rozdzielania lantanowców, głównie chromatografii, pozwoliło zidentyfikować otrzymywane w następnych latach sztuczne pierwiastki. O doskonałości technologii i biegłości eksperymentatorów świadczy fakt, że obecność niektórych nowych pierwiastków stwierdzono, dysponując zaledwie kilkunastoma ich atomami! (5).
Nie sądź jednak, że tor czy uran nagle zmieniły swoje właściwości i stały się podobnymi do lantanowców, trójwartościowymi metalami. Nadal więcej łączy je z tytanowcami i chromowcami niż z pozostałymi aktynowcami. Podobnie jest z protaktynem, a nawet kilku transuranowcami. O pewnym podobieństwie można mówić dopiero w drugiej połowie szeregu. Stanowczo jednak nie da się stwierdzić, że lantanowce i aktynowce to rodziny pokrewne (jakby sugerowało ich położenie w układzie okresowym).
Brak danych doświadczalnych
Niedokładne poznanie właściwości najcięższych transuranowców wiąże się z niedostateczną ilością materiału do badań. Ostatnim pierwiastkiem, który produkowany jest w dostrzegalnych, miligramowych ilościach jest einstein zajmujący 99. pozycję w tablicy. Oczywiście, prowadzone są eksperymenty i z następnymi transuranowcami, ale w ich przypadku bada się np. charakterystyczne promieniowanie pojawiające się w osadzie, nie zaś obserwuje tworzenie kryształów związku.
Właściwości fizykochemicznych nie można po prostu zmierzyć, lecz jedynie oszacować na podstawie pośrednich obserwacji. Podobny problem występuje w przypadku dwóch lżejszych pierwiastków: astatu (nr 85) i fransu (nr 87). Krótkie czasy życia spowodowały, że nie otrzymano jeszcze ich widocznych ilości i teoria musi uzupełnić braki obserwacji i pomiarów. Z drugiej strony roczna produkcja plutonu, występującego w śladowych ilościach w skorupie ziemskiej, sięga kilku ton i jest on lepiej poznany niż wiele lżejszych, trwałych pierwiastków.
Jeszcze większy problem jest z najcięższymi pierwiastkami 7 okresu położonymi za aktynowcami. W ich przypadku trzeba operować dosłownie pojedynczymi atomami o czasach życia liczonych w ułamkach sekund. Nie da się już stwierdzić promieniotwórczości występującej w osadzie związku pokrewnego pierwiastka, lecz jedynie zbadać niektóre właściwości fizyczne (np. szybkość osadzania na danej powierzchni) i stąd wyciągać wnioski o podobieństwie chemicznym. Pomaga oczywiście teoria, a ściślej obliczenia na podstawie mechaniki kwantowej. Wyniki nie są jednak 100-procentowo pewne, np. od wyznaczonego rozmieszczenia elektronów na powłokach daleko jeszcze do opisu właściwości chemicznych. Im bardziej oddalamy się od bezpośrednich danych obserwacyjnych, tym wnioskowanie "metodą Mendelejewa" (czyli na podstawie właściwości znanych pierwiastków) staje się coraz bardziej zawodne.
Chemicy i fizycy próbują przewidywać własności nawet najcięższych, jeszcze nieotrzymanych pierwiastków z kolejnego okresu. Pierwiastki 119 i 120 będą miały zapewne cechy niewiele różniące się od położonych wyżej fransu i radu (w grupie 1 i 2 zmiana właściwości fizykochemicznych jest dość regularna). W okresie 8, na podobieństwo lantanowców i aktynowców, pojawi się szereg aż 18 bardzo do siebie zbliżonych własnościami pierwiastków bloku g, z którymi uczeni nie mieli jeszcze do czynienia.
Obliczenia sugerują istnienie w tym okresie pierwiastków o wartościowości sięgającej 12. Układ prawdopodobnie skończy się na pierwiastku 164, dla cięższych ładunek jądra będzie tak duży, że elektrony spadną na nie, a szybkość ruchu po orbitach przekroczyłaby prędkość światła. Wykonane rachunki nie dają jednoznacznych wyników, niektórzy przesuwają granice układu okresowego jeszcze o kilkanaście pierwiastków.
Prawo okresowości do kosza?
Na podstawie lektury artykułu doszedłeś zapewne do wniosku, że duża liczba wyjątków od podawanych w szkole reguł upoważnia do twierdzącej odpowiedzi na zadane pytanie. Nie udzielaj jej jednak zbyt szybko. Prawo okresowości sformułowane jest bardzo ogólnie (własności powtarzają się okresowo), co stanowi zarówno jego zaletę, jak i wadę. Zaletę, ponieważ rzeczywiście, analizując położenie pierwiastka w zbudowanej na podstawie prawa tablicy, można wyciągnąć wnioski o jego właściwościach fizykochemicznych. Wadę, ponieważ wnioski często okazują się niezbyt dokładne lub wręcz fałszywe.
Prawo okresowości dobrze sprawdza się w grupach głównych (1, 2, 13-18), lepiej w górnych ich częściach niż w dolnych. Idealnym przykładem jest okres 3: od sodu do argonu wartościowości oraz własności chemiczne zmieniają się regularnie, bez żadnych niespodzianek. W grupach pobocznych (3-12) odstępstwa są już wyraźnie widoczne, natomiast o problemach z lantanowcami i aktynowcami czytałeś wyżej. Generalnie im dalej od początku układu, tym prawo okresowość jest coraz mniej dokładnie spełniane.
Zatem do kosza? Uniwersum pierwiastków chemicznych i tworzonych przez nie związków to system tak złożony, że nawet genialny pomysł Mendelejewa nie jest w stanie objąć go w całości. Prawo na pewno wymaga poprawek i uściślenia. Jeżeli porównamy Mendelejewa do Newtona (ponieważ zarówno prawo okresowości, jak i teoria grawitacji uporządkowały i wyjaśniły duże fragmenty otaczającego świata), można stwierdzić, że chemicy nadal czekają na swego Einsteina.
Krzysztof Orliński
Zobacz także:
Nieznany układ okresowy, część 1
Nieznany układ okresowy, część 2