Chemiczny Nobel 2020, czyli nowe katalizatory
Po ubiegłorocznym Noblu za typowe prace biochemiczne, nagroda tym razem przypadła chemikom, ale osiągnięcia laureatów ściśle związane są ze światem organizmów żywych. Od Natury mamy się czego uczyć, ponieważ - mimo wspaniałego rozwoju chemii - nadal wiele nam brakuje do jej osiągnieć (choć trzeba przyznać, że na swoje "eksperymenty" miała znacznie więcej czasu, skromnie licząc 3,5 miliarda lat). Prace Lista i MacMillana to okres dwóch ostatnich dekad, ale dla zrozumienia ich znaczenia trzeba cofnąć się aż do wieku XIX.
Akceleratory chemiczne…
Pojęcia kataliza i katalizator oficjalnie weszły do użycia w roku 1835. Ich autorem była gwiazda pierwszej wielkości chemii początków XIX wieku - Jöns Jacob Berzelius (zawdzięczamy mu m.in. powszechnie stosowaną symbolikę pierwiastków). Obie nazwy pochodzą z greki, gdzie katalizejn znaczy rozdzielać. Berzelius określił katalizę jako zjawisko polegające na przyspieszeniu biegu reakcji chemicznej pod wpływem dodanej substancji - katalizatora.
Szwedzki chemik oparł się na przykładzie rozkładu wody utlenionej (roztwór nadtlenku wodoru) zachodzącego z udziałem różnych substancji, np. metalicznego srebra czy też miedzi (1). Berzelius nie był pierwszym, który dokonał stosownych obserwacji (już ponad 20 lat wcześniej zastosowano katalityczne działanie kwasu siarkowego do otrzymywania glukozy ze skrobi), ale to on wprowadził katalizę na "chemiczne salony".
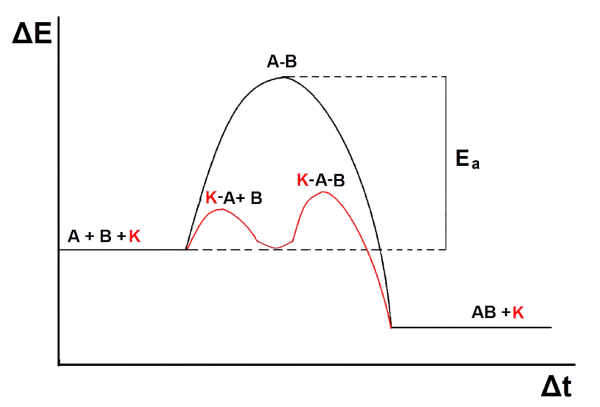
Wkrótce także inni chemicy zaczęli badać wpływ różnych substancji na szybkość reakcji chemicznych. Dociekania przyniosły wyjaśnienie działania katalizatora: modyfikuje on mechanizm procesu, dzięki czemu wysoka bariera energetyczna bezpośredniej reakcji pomiędzy substratami ulega zmianie na kilka mniejszych "pagórków", a te jest łatwiej pokonać cząsteczkom reagentów (2). To mniej więcej tak, jakbyś miał za jednym razem przenieść 100-kilogramowy ładunek lub też dźwigać kilka razy, ale mniejsze paczki.
Katalizator czasem zmienia proporcje produktów reakcji - dzieje się tak, gdy substraty mogą ze sobą reagować w różny sposób, a katalizator wpływa tylko na jedną z dróg przemiany. Pamiętaj także, że katalizator to nie czarodziej i przyspieszy tylko taką reakcję, która zajdzie również bez niego, chociaż czasem z niezauważalną szybkością (np. mieszanina tlenu i wodoru w temperaturze pokojowej może być przechowywana latami bez widocznej zmiany, ale wystarczy włożyć do niej blaszkę platynową, aby nastąpił wybuch).
Katalizatory szybko zastosowano w przemyśle chemicznym i dziś już nie wyobrażamy sobie wielkotonażowej produkcji bez ich udziału: paliwa, tworzywa sztuczne, amoniak, kwas siarkowy - to tylko najważniejsze przykłady. Przemysłowe katalizatory to głównie metale (często rzadkie i drogie, np. platyna, ren czy trudne do otrzymania lantanowce) i ich związki. Szacuje się, że procesy katalityczne odpowiadają za 35% światowej ekonomii, oczywiste jest zatem, że przemysł wykłada ogromne środki na ich badania.
…i biochemiczne
Natura również skorzystała z mechanizmu katalizy. Życie jest formą istnienia białka (jak napisała Agnieszka Osiecka, a potem śpiewali Skaldowie), zatem i biokatalizatory to molekuły białkowe, a w ich skład często wchodzą także jony metali i witaminy. Ludzie od tysięcy lat stosowali je praktycznie, wytwarzając wino i piwo, zaczyn do produkcji pieczywa, sery czy ocet. Oficjalnie enzymy pojawiły się w roku 1877, a nazwę nadał im niemiecki fizjolog Wilhelm Kühne. Pochodzi ona, jak wiele innych, z greki, gdzie enzymos można przetłumaczyć jako "z drożdży" (do dziś używanych w procesach fermentacyjnych) (3).
Enzymy to, w porównaniu z katalizatorami przemysłowymi, akceleratory prawie doskonałe: z wielką wydajnością działają w temperaturze ciała i pod normalnym ciśnieniem. W dodatku wykazują się wysoką selektywnością, przyspieszając na ogół tylko jedną reakcję. Typowe zaś warunki prowadzenia procesów przemysłowych to temperatury rzędu setek stopni Celsjusza i ciśnienie często sięgające kilkuset atmosfer. W dodatku udział produktów ubocznych w procesach przemysłowych bywa znaczący, co zwiększa koszty produkcji (straty surowca, konieczność oczyszczania produktu i utylizacji odpadów).
Chemicy i przemysł korzystają zarówno z katalizatorów metalicznych, jak i enzymów. O ile te pierwsze można porównać do ciężkiego sprzęt do cięcia i kruszenia, to enzymy jawią się jako precyzyjne narzędzia do mikrochirurgii. Potrzebne było jeszcze coś pomiędzy nimi, ot, jakby przybory do użytku domowego.
Wyjąć część enzymu…
Benjamin List przebywał na stażu w jednym z kalifornijskich instytutów badawczych, gdzie zajmował się przeciwciałami. Jego celem była taka zmiana ich działania, aby pracowały jak "normalne" enzymy, czyli były katalizatorami Jednak przeciwciała to także białka, a te - jak wiadomo - nie wytrzymują wysokich temperatur (50°C wystarczy, aby je "ugotować"), stężonych roztworów kwasów i zasad, soli metali ciężkich. Ogólnie należy obchodzić się z nimi "jak z jajkiem".
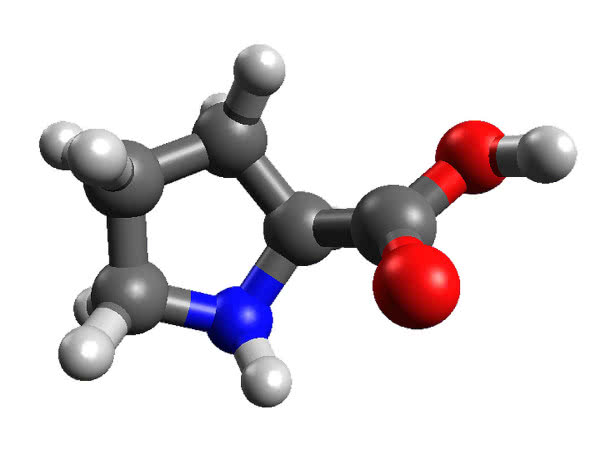
List wiedział, że za właściwe działanie katalityczne odpowiada centrum aktywne enzymu, czyli zazwyczaj wgłębienie na jego powierzchni, do którego dostają się cząsteczki substratów. Enzym składa się z co najmniej 100 molekuł aminokwasów, ale zadaniem większości jest tylko takie ukształtowanie jego struktury, aby powstało centrum aktywne. List pomyślał: przecież aktywność katalityczną mogą wykazywać także pojedyncze cząsteczki aminokwasów z centrum aktywnego, a te nie są tak wrażliwe jak białka. Już pierwsze próby z proliną (często znajduje się w centrach aktywnych) wypadły nadzwyczaj dobrze: aminokwas przyspieszał pewne rekcje i korzystnie zmieniał proporcje ich produktów (4).
Po publikacji odkrycia (luty 2000 roku) chemicy nie mogli wyjść ze zdumienia, że tak proste rozwiązanie nikomu do tej pory nie przyszło do głowy i wkrótce prasa fachowa zaroiła się od doniesień o podobnym działaniu innych związków organicznych. Odpowiednia modyfikacja nowych katalizatorów pozwoliła z dużą wydajnością otrzymywać pojedyncze izomery optyczne. Tym mianem określa się cząsteczki zbudowane z tych samych atomów, połączonych ze sobą w tej samej kolejności, a różniące się tylko tym, że jedna jest lustrzanym odbiciem drugiej (stąd też słowo "asymetryczna" w uzasadnieniu przyznania nagrody). Tak subtelna różnica często ma kolosalne znaczenie dla właściwości odmian, np. mają one różny zapach, jedna działa leczniczo, druga może być nieaktywna lub nawet toksyczna.
…i zastąpić metal
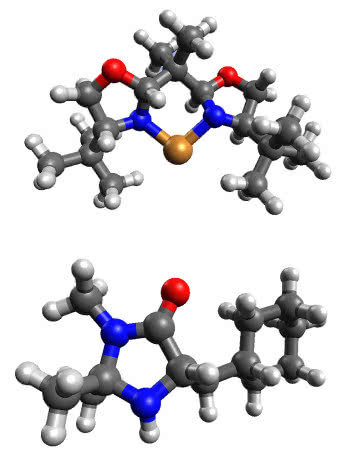
W tym samym czasie w innym kalifornijskim laboratorium David MacMillan badał katalizatory złożone z atomu metalu połączonego z cząsteczką organiczną. Działały dobrze, ale były nadzwyczaj wrażliwe na tlen i wodę, które powodowały rozkład związków. O ile w laboratorium można było zapewnić odpowiednie warunki ich pracy (brak dostępu tlenu i wilgoci), o tyle w skali przemysłowej było to praktycznie niewykonalne. MacMillan przebudował cząsteczkę katalizatora tak, aby zawierała ugrupowanie iminowe (obecne także w prolinie), które może przyjmować i oddawać elektrony podobnie do atomu metalu. Pomysł okazał się dobry i katalizator skutecznie przyspieszał wybrane przemiany. MacMillan jest również autorem pojęcia kataliza organiczna (organocatalysis) (5).
Katalizatory organiczne to obecnie przedmiot intensywnych badań. Ich użycie pozwala przeprowadzić niektóre procesy z większą niż dotychczas wydajnością i selektywnością produktów (np. przy produkcji farmaceutyków). Czy zastąpią dotychczas stosowane? Nie, zarówno metale, jak i enzymy to wyspecjalizowane narzędzia w zakresie swoich "kompetencji", o dobrze opracowanych sposobach użycia. Katalizatory organiczne za to wypełnią lukę pomiędzy nimi, stając się trzecim filarem chemicznej technologii.
Krzysztof Orliński