Grupa druga. Mistrz wagi lekkiej - część 2
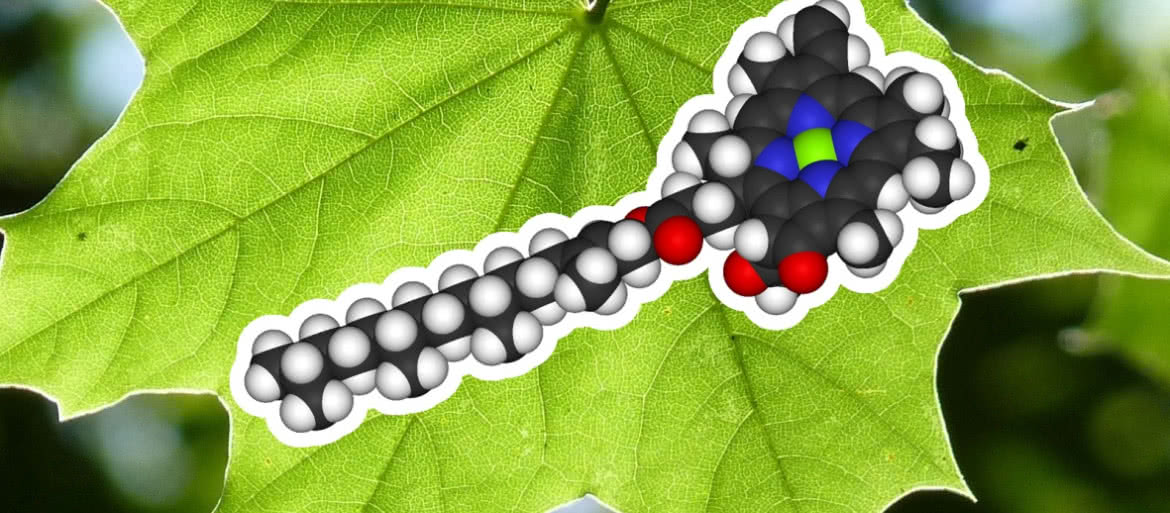
Jeżeli zdziwiło cię zdanie z poprzedniego akapitu, pomyśl o chlorofilu. Dzięki zielonemu barwnikowi rośliny mogą wykorzystać energię światła słonecznego do syntezy związków organicznych z dwutlenku węgla i wody, co jest podstawą wyżywienia zwierząt, nas samych nie wyłączając. A w środku pierścieniowego układu tworzącego molekułę chlorofilu tkwi jon magnezu (1).
Lekki metal…
Lekki, bo gęstość magnezu to tylko 1,7 gęstości wody (2). Do tego dość odporny chemicznie w niezbyt wysokiej temperaturze (pokrywa się ochronną warstwą tlenku, która chroni go przed dalszą korozją - mówimy, że metal pasywuje). Reaguje z wrzącą wodą, niektórymi kwasami oraz większością niemetali. W tworzonych związkach jest, zgodnie z numerem grupy, dwuwartościowy. Podgrzany do 750-800°C spala się w powietrzu z oślepiającym blaskiem (3).
Dawniej wykorzystywano płonący magnez w fotograficznych lampach błyskowych, a wojsko stosuje go nadal w roli składnika flar oświetlających i ładunków zapalających. Na starych filmach można zauważyć charakterystyczny dym podczas robienia zdjęć przez ówczesnych fotografów.
To powstający w reakcji spalania tlenek magnezu MgO z domieszką azotku Mg3N2.
Niewielka gęstość magnezu czyni z niego pożądany materiał konstrukcyjny. Stosowany jest wraz z glinem, cynkiem i manganem, co pozwala uzyskać wytrzymałe i niekorodujące lekkie stopy (magnalium, elektron) wykorzystywane w przemyśle lotniczym, rakietowym i motoryzacyjnym oraz jako obudowy urządzeń (sprzęt AGD, laptopy, smartfony, aparaty fotograficzne) (4). Metaliczny magnez jest łatwy do otrzymania i dość tani, a duże powinowactwo do tlenu umożliwia jego zastosowanie w metalurgii tytanu, cyrkonu i hafnu.
Stopy magnezu nabrały znaczenia w latach 20. ubiegłego wieku wraz z rozwojem lotnictwa, ale połączenia tego pierwiastka znane są od dawna. Ze związków magnezu najczęściej stosowany jest tlenek jako materiał żaroodporny i wypełniacz do produkcji papieru, gumy i tworzyw sztucznych. Stanowi on również składnik cementów budowlanych i kitów. Tlenek magnezu to także nietoksyczny komponent kosmetyków i past do zębów oraz składnik popularnych preparatów zwalczających nadkwasotę (wraz z wodorotlenkiem oraz związkami glinu).
…który jest wszędzie
Magnez stanowi ponad 2% powierzchniowych warstw skorupy ziemskiej, tzw. sialu (nazwa pochodzi od symboli dominujących, w tworzących ją granitach, pierwiastków - krzemu i glinu). Na większych głębokościach jest go jeszcze więcej - ta warstwa z kolei nazywa się simą (w występujących tam bazaltach przeważają krzem i magnez).
Magnez wchodzi w skład licznych minerałów, z których magnezyt MgCO3 i dolomit (zmieszany węglan magnezu i wapnia) budują całe łańcuchy górskie. Woda morska zawiera około 0,15% magnezu w postaci rozpuszczonych związków. Wydaje się, że to niewiele, ale w kilometrze sześciennym wód oceanu znajduje się 1,5 mln ton magnezu, co przekracza roczną produkcję całego świata. Nie grozi nam więc brak lekkiego metalu.
Podstawową metodą otrzymywania magnezu jest elektroliza stopionego chlorku. Ten zaś związek otrzymuje się w wyniku przeróbki minerałów magnezu lub z wodorotlenku wytrąconego z wody morskiej (za pomocą mleka wapiennego, czyli roztworu wodorotlenku wapnia). Innym sposobem jest redukcja tlenku magnezu węglem w wysokiej temperaturze: powstający metal odparowuje, a następnie kondensuje w chłodniejszych częściach aparatury.
Biopierwiastek…
O chlorofilu była już mowa, ale magnez to także jeden z głównych kationów wewnątrzkomórkowych, aktywujący liczne enzymy. Bierze udział w procesach obronnych organizmu, działa uspokajająco i przeciwstresowo, chroni serce, przeciwdziała miażdżycy i skurczom mięśni.
W zbilansowanej diecie zapotrzebowanie na magnez jest całkowicie zaspokajane. Jednak nadużywanie alkoholu i kawy, spożywanie nadmiernie konserwowanej żywności oraz stres powodują obniżenie zawartości tego pierwiastka w organizmie. Preparaty magnezu stosuje się w stanach przemęczenia fizycznego i psychicznego, a ich działanie wzmacnia witamina B6. Oczywiście od tabletek smaczniejsze są produkty naturalne, te szczególnie bogate w magnez, to kakao, czekolada, kasze i orzechy (5).
…z zagmatwaną historią
W starożytności, w pobliżu miasta Magnesia (obecnie Manisa w Turcji) znaleziono minerał, który przyciągał opiłki żelaza. Jego łacińską nazwą przez wieki była magnesia (po spolszczeniu magnezja). Dziś minerał ten zwie się magnetytem i jest najbogatszą rudą żelaza o składzie Fe3O4 (od nazwy minerału pochodzi również nazwa magnetyzm). W pobliżu często znajdowano brunatny minerał, również uważany za rudę żelaza, choć jest to dwutlenek manganu MnO2. Nie odróżniano ich i przez wieki oba były zwane magnezją, ta druga czasem z dodatkiem "czarna" (łac. magnesia nigra). W średniowieczu brunatny minerał stał się braunsztynem (z niem. braun = brązowy i Stein = kamień).
W XVII wieku w okolicach angielskiego miasta Epsom odkryto gorzkie źródła, których wody miały własności przeczyszczające. Ponieważ, zgodnie z ówczesnymi poglądami medycznymi takie działanie miało leczyć wiele chorób, miejscowość stała się popularna, a sól powstałą po odparowaniu wody sprzedawano w całej Europie. Sól z Epsom, zwana także solą gorzką, to krystaliczny siarczan magnezu MgSO4×7H2O. W początkach XVIII wieku sól gorzką uzyskano również z innych źródeł, a w wyniku jej przekształceń powstał biały proszek, który ktoś - nie wiadomo dlaczego - nazwał magnezją białą (łac. magnesia alba). Nazwa się przyjęła, choć z prawdziwą magnezją związek nie miał nic wspólnego. Był to tlenek magnezu.
W II połowie XVIII wiedziano już, że w braunsztynie nie ma żelaza, a magnezja biała, choć podobna do ziemi wapniowej CaO, zawiera metal o odrębnych właściwościach. Z magnezji czarnej wyodrębniono pierwiastek jeszcze przed końcem stulecia (początkowo zwany magnezem, ale to akurat nie powinno dziwić), na białą przyszło poczekać do roku 1808. Sir Humpry Davy ponownie (jak w przypadku strontu i baru z poprzedniego odcinka) zastosował elektrolizę zwilżonego wodą tlenku i wydzielony metal rozpuścił się w stanowiącej katodę rtęci, którą następnie odparowano. Nazewnicze kłopoty również zostały rozwiązane: metal z braunsztynu stał się manganem, a bohater dzisiejszego artykułu - magnezem.
Pastelowy eksperyment
W analizie chemicznej magnez wykrywany jest razem z litowcami, ponieważ wiele jego związków rozpuszcza się w wodzie. Do trudno rozpuszczalnych należą wodorotlenek, węglan i fluorek (dwa ostatnie analogicznie jak w przypadku litu, z którym łączy go reguła diagonalnego podobieństwa). Pozostawiam ci wykonanie odpowiednich prób. W przeciwieństwie do litowców i cięższych berylowców, sole magnezu niestety nie barwią płomienia palnika.
Tlenek magnezu umożliwi za to przeprowadzenie ciekawego eksperymentu. Potrzebne będą: tlenek magnezu MgO, 5% kwas solny HCl, roztwór błękitu bromotymolowego, zlewka i bagietka. Do zlewki wsyp 1-2 łyżeczki tlenku magnezu, wlej 30-50 cm3 wody i zamieszaj zawartość naczynia (jeśli dysponujesz mieszadłem magnetycznym, możesz "zautomatyzować" pokaz). Kontynuując mieszanie, dodaj 2-3 krople roztworu wskaźnika, a następnie wlej kilka cm3 kwasu solnego. Po zaobserwowaniu efektów ponownie dodaj taką samą ilość roztworu HCl i mieszaj dalej.
Prawda, że widowiskowe? Tlenek magnezu tworzy z wodą mleczną zawiesinę, która po dodaniu roztworu błękitu bromotymolowego barwi się na niebiesko. Po wlaniu kwasu solnego zawartość zlewki przybiera żółty kolor, ale po chwili znów staje się niebieska. Dodawanie kolejnych porcji kwasu solnego powoduje powtórzenie sekwencji zmiany barw (6).
Jak to wyjaśnić? Tlenek magnezu powoli reaguje z wodą, tworząc wodorotlenek tego metalu. Powstający związek słabo rozpuszcza się w wodzie (ok. 0,01 g na litr, mleczna zawiesina w roztworze to tlenek i wodorotlenek), ale jest mocną zasadą, co wystarcza do zmiany barwy błękitu bromotymolowego na niebieską.
Dodatek kwasu solnego powoduje zobojętnienie wodorotlenku magnezu, a nadmiar kwasu - zmianę barwy wskaźnika na żółtą. Wtedy kolejna porcja MgO reaguje z wodą, zobojętnia nadmiar kwasu i alkalizuje środowisko - wskaźnik ponownie przyjmuje niebieskie zabarwienie. Dodatek następnej porcji kwasu solnego pozwala na powtórzenie cyklu (aż do wyczerpania całej ilości tlenku). Zmiana wskaźnika da inne efekty barwne. W przypadku fenoloftaleiny będzie to różowe i mleczne zabarwienie, a oranżu metylowego - żółte i różowe (7). W każdym przypadku mleczna zawiesina tonuje barwy wskaźników na łagodne, pastelowe.
To tyle na temat magnezu. Jego przeważnie białe związki nie umożliwiają wykonania kolorowych doświadczeń (8). Wiesz zapewne, że nie wszystko złoto, co się świeci, ale chemia udowadnia, że nie wszystko, co się nie świeci, nie jest cenne. Najlepszy przykład to magnez, metal o coraz większym znaczeniu w naszej cywilizacji.
Krzysztof Orliński













