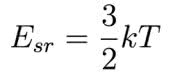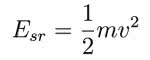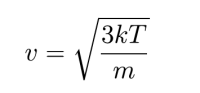Chaotyczne ruchy cząstek - część 1. Dyfuzja

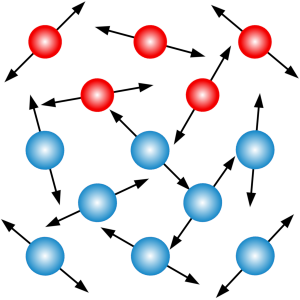
Ponieważ nie widzimy wewnętrznej budowy materii, nie jesteśmy również w stanie dostrzec, że atomy i cząsteczki pozostają w nieustannym ruchu. A ściślej rzecz biorąc, poruszają się w temperaturach wyższych od temperatury zera bezwzględnego. W przypadku gazów i cieczy najważniejszą rolę w procesie dyfuzji odgrywa ruch postępowy. W ciałach stałych z kolei istotny jest ruch drgający cząsteczek wokół ich położeń równowagi.
Niezależnie od rodzaju ruchu istnieje ścisły związek pomiędzy prędkością cząsteczek a temperaturą. Średnia energia ruchu postępowego cząsteczek gazu w przestrzeni trójwymiarowej dana jest wzorem
gdzie k jest stałą Boltzmanna. Porównując to wyrażenie z wyrażeniem na energię kinetyczną
możemy znaleźć zależność średniej prędkości cząsteczki od temperatury. Po bardzo prostych przekształceniach dostajemy
Pamiętać przy tym należy, że w tym przypadku oznacza średnią prędkość kwadratową, a nie średnią arytmetyczną prędkości.
Odrobina historii
Zjawisko dyfuzji jest tak powszechne, że z pewnością było znane przed jego oficjalnym odkryciem. Prawdopodobnie jednak nie widziano w nim nic szczególnego i nie przykładano do niego większej wagi. Za odkrywcę dyfuzji cieczy uważany jest francuski fizyk i wynalazca Jean-Antoine Nollet, żyjący w XVIII wieku.
Matematyczny opis przebiegu procesu dyfuzji został sformułowany dopiero w kolejnym stuleciu przez niemieckiego uczonego Adolfa Ficka. Opis ten jest aktualny do czasów obecnych i szeroko stosowany do tworzenia modeli matematycznych między innymi w farmakologii (np. przenikanie leków do tkanek) czy inżynierii materiałowej (np. technologia domieszkowania półprzewodników).
Fizyczne podstawy procesu dyfuzji
Jeśli chodzi o gazy lub ciecze, to ich cząsteczki (ewentualnie atomy w przypadku gazów szlachetnych) mogą poruszać się swobodnie w całej objętości ośrodka. Ponieważ żaden kierunek nie jest wyróżniony, wektory prędkości poszczególnych cząsteczek są zorientowane losowo w przestrzeni. W efekcie cząsteczki jednej substancji mogą przedostawać się w obszar zajmowany przez drugą substancję. Dodatkowo pomiędzy cząsteczkami może dochodzić do zderzeń, które sprzyjają dalszemu mieszaniu się substancji i wyrównywaniu ich stężeń.
W przypadku ciał stałych ich cząsteczki (lub atomy kryształów) mogą tak mocno wychylać się ze swoich położeń, że dojdzie do zamiany miejscami cząsteczek dwóch substancji. Na skutek kolejnych takich procesów jedna substancja dyfunduje w głąb drugiej. Również w tym przypadku granica między substancjami zaciera się, a stężenia ulegają wyrównaniu. Możliwa jest także dyfuzja na granicy ciał w dwóch różnych stanach skupienia. Na przykład cząsteczki cieczy mogą wybijać i odrywać cząsteczki ciała stałego.
Propozycja doświadczeń
Zarówno w warunkach szkolnych, jak i w domu bardzo łatwo wykazać, że szybkość procesu dyfuzji zależy od temperatury. Wystarczy przygotować dwa lub trzy jednakowe naczynia, wodę oraz jakąś substancję z barwnikiem. Może to być mocny napar herbaty lub niesłodzony sok w intensywnym kolorze.
Naczynia z samym barwnikiem należy najpierw ustawić w wybranych miejscach różniących się temperaturą (na przykład kaloryfer, lodówka i pomieszczenie o temperaturze pokojowej). Dopiero w następnym kroku bardzo ostrożnie dolewamy wody, uważając, aby nie wymieszać substancji. Co jakiś czas sprawdzamy wygląd cieczy i notujemy spostrzeżenia.
W bardzo podobny sposób można wykonać doświadczenie polegające na badaniu tempa dyfuzji cieczy w głąb ciała stałego. Wystarczy przygotować trzy kostki cukru, na każdą z nich nanieść kroplę soku i umieścić je w miejscach o różnych temperaturach.
Sprawdź swoją wiedzę
Upewnij się, że rozumiesz wszystkie pojęcia, o których mowa w niniejszym tekście. W tym celu rozwiąż krzyżówkę. Litery w zaznaczonych polach utworzą hasło po ułożeniu ich w odpowiedniej kolejności.
Joanna Borgensztajn
1. Są z nich zbudowane cząsteczki.
2. Ich budowa wewnętrzna jest podobna do budowy gazów.
3. W przypadku cząsteczek jej średnia kwadratowa zależy od temperatury.
4. Jest miarą ilości substancji w mieszaninie.
5. Wykonują go cząsteczki w temperaturach wyższych od zera bezwzględnego.
6. Może być skupienia lub cywilny.
7. Na przykład Boltzmanna.
8. Ciało o regularnej wewnętrznej strukturze.