Wiek żelaza - część 1

Rzymski poeta Owidiusz w Przemianach opisał mityczne wieki ludzkości, w dużej mierze zgodne z rozwojem cywilizacji. I tak po szczęśliwych wiekach złotym i srebrnym (tu autora poniosła fantazja, bo był to okres kamienny), zapanował wiek spiżu, będącego jednym ze stopów miedzi i cyny. W tym czasie żyli Herakles, Tezeusz i Argonauci, a zakuci w spiżowe pancerze bohaterowie Homera spiżowymi mieczami walczyli pod murami Troi. Archeolodzy okres ten nazywają epoką brązu. Po niej (za Owidiuszem)…
…nastał wiek twardym przezwany żelazem
Kiedy się rozpoczął? Trudno odpowiedzieć na to pytanie. Najstarsze przedmioty wykonane z żelaza pochodzą aż z IV tysiąclecia przed naszą erą, a może i z jeszcze dawniejszych czasów. I nie było to "byle jakie" żelazo, ale niebiańskie, a ściśle pochodzenia meteorytowego (1). Nic dziwnego, że traktowano je jako prawdziwy dar bogów i odpowiednio do tego szanowano.
Z czysto ziemskim żelazem człowiek zapoznał się, gdy zaczął otrzymywać metale z rud, a nie z samorodków. Z miedzią, cyną i ołowiem szło mu nieźle: w temperaturach możliwych do uzyskania w ówczesnej konstrukcji piecach (sięgających co najwyżej 1000°C) metale te topiły się i dawały odlewać, a ich miękkość pozwalała na łatwą obróbkę za pomocą kucia.
Z żelazem nie było tak prosto. Po pierwsze topi się ono w temperaturze przekraczającej 1500°C, a po drugie na zimno jest twarde i nie dawało się kształtować metodami sprzed tysiącleci. Początkowo stanowiło uciążliwy produkt uboczny w procesie wytopu miedzi (rudy miedzi i żelaza często występują obok siebie) - na dnie pieca pozostawał kawał gąbczastej, twardej masy. Było to żelazo powstałe ze zredukowanych tlenków wchodzących w skład rudy. Przypadek zapewne sprawił, że pradawny hutnik-kowal zaczął obrabiać otrzymaną łupkę (od łacińskiego lupus, czyli wilk), zanim jeszcze ostygła (2). Tym razem metal dawał się dość łatwo kształtować. Choć, jak na dzisiejsze standardy, było to bardzo niskiej jakości żelazo, i tak okazało się twardsze od wszystkich znanych wtedy metali.
Twardość żelaza zależy od ilości rozpuszczonego w nim węgla (pochodził z używanego do wytopu węgla drzewnego), a ta z kolei od temperatury wytopu - rośnie wraz z nią. W prymitywnych piecach otrzymywano żelazo niskowęglowe (zawartość węgla wynosiła co najwyżej 0,5%).
Jednak technologia ciągle się rozwijała. Lepszej konstrukcji piece pozwalały osiągać wyższe temperatury, dzięki czemu więcej węgla rozpuszczało się w żelazie. Gdy jego zawartość doszła do około 1%, człowiek po raz pierwszy poznał stal. Wykonane z niej ostrza nie tępiły się szybko, a ponadto można było ją zahartować, co dodatkowo zwiększało twardość. Od tego czasu nowy metal zaczął szybko wypierać brąz. Kiedy doszło do tego przełomu? Około połowy drugiego tysiąclecia przed naszą erą na terenach dzisiejszej Syrii i Anatolii (Turcja). Stamtąd stal rozprzestrzeniła się na cały ówczesny świat, choć w różnych jego częściach niezależnie od siebie dokonywano tego wynalazku (np. w Indiach i Chinach).
Dlaczego jednak żelazo, mimo problemów z jego produkcją, wyparło brąz? Tym razem oddajmy głos Bolesławowi Prusowi, który w Faraonie tak oto opisał zalety nowego tworzywa: "jeden z egipskich oficerów wydobył swój miecz spiżowy i trzymał go, jak do ataku. Wtedy Sargon podniósł miecz stalowy, uderzył i odciął kawałek broni przeciwnika".
Metal wojny
Akcja powieści toczy się w XI wieku przed nasza erą, ale już wcześniej lepsze uzbrojenie oznaczało przewagę na polu bitwy. Nie jest zapewne przypadkiem, że wynalazku produkcji stali dokonali Hetyci, naród wojowników. Po nich przejęli go równie waleczni Asyryjczycy, których poseł Sargon w tak obrazowy sposób pokazał młodemu następcy egipskiego tronu zalety nowej broni. Od tamtej pory żelazo na zawsze związało się z wojną, poświęcono je bogom opiekującym się tą dziedziną życia oraz krwawej barwy planecie Mars (3).
Mijały wieki, doskonalono technologię wytopu i obróbki (na terenach Polski już w VII wieku p.n.e. istniało rozwinięte hutnictwo). Ich tajniki były pilnie strzeżone, a udane wynalazki zdobywały wielką sławę, np. doskonała stal damasceńska. Oprócz niewielkich, prymitywnych dymarek, coraz częściej do wytopu budowano duże piece. W średniowiecznej Europie po raz pierwszy udało się osiągnąć temperaturę topnienia żelaza i - zamiast gąbczastej masy leżącej na dnie paleniska - z pieca popłynął ciekły metal, czyli tzw. surówka. Nie wzbudziło to jednak zachwytu: stop o dużej zawartości węgla (żeliwo) był kruchy i nie można go było kuć, nadawał się jedynie na odlewy (do dziś zresztą jest używany do tego celu).
Przełom w produkcji stali nastąpił w XVIII, a zwłaszcza XIX wieku. Najpierw do wytopu zastosowano koks (odgazowany węgiel kamienny) zamiast węgla drzewnego. Stało się to w Anglii, gdzie hutnictwo przyczyniło się do znacznego wylesienia kraju (zapotrzebowanie na koks było natomiast bodźcem do szybkiego rozwoju górnictwa węgla kamiennego). Opracowanie metod otrzymywania stali z wytopionej surówki poprzez usuwanie nadmiaru węgla oraz innych dodatków (fosforu, siarki, krzemu) spowodowało, że stal stała się tania i dostępna w dużych ilościach, co z kolei było początkiem jej powszechnego użycia jako materiału konstrukcyjnego.
Procesy technologiczne z XIX wieku - Bessemera, Thomasa, a zwłaszcza Siemensa-Martina - do dziś są podstawą produkcji stali (oczywiście doczekały się licznych udoskonaleń). Chociaż współcześnie nie pracuje się już metodą prób i błędów, a specjaliści z różnych dziedzin badają procesy wytopu i obróbki stali, to nadal jednak hutnictwo ma w sobie dodatek sztuki. Specjalistów w tej dziedzinie można przyrównać do mistrzów kuchni, którzy za pomocą odpowiednio dobranych przypraw potrafią uzyskać smakowite potrawy. W tym przypadku funkcję przypraw pełnią dodatki stopowe (czyli różne pierwiastki), a gotowe potrawy to stopy "na każdą okazję".
Metal numer 1
Żelazo to podstawa naszej cywilizacji, niech zresztą przemówią liczby. W roku 2019 na świecie wytopiono 1300 mln ton surówki, z czego około 10% przeznaczono na wyroby żeliwne, reszta została przetworzona na stal. Samej stali wyprodukowano około 1900 mln ton (różnica to stalowy złom dodawany podczas przerobu surówki). "Stalownią świata" są Chiny, które dostarczają ponad połowę produkcji (Polska około 10 mln ton). Roczna produkcja metalu numer 2, czyli aluminium, wynosi niespełna 80 mln ton, co w porównaniu z dwoma miliardami ton stali i żeliwa w pełni dowodzi, że nadal żyjemy w epoce żelaza (4).
Na Ziemi mamy dużo żelaza, powierzchniowa warstwa zawiera go 5,6%, co stawia ten metal na 4. miejscu (po tlenie, krzemie i glinie). Jeżeli potraktować Ziemię jako całość, żelazo prowadzi, stanowiąc prawie jedną trzecią masy globu (w centrum planety obecne jest żelazowo-niklowe jądro o średnicy prawie 7000 km). We Wszechświecie żelazo znajduje się na 6. miejscu pod względem rozpowszechnienia, jest też najcięższym pierwiastkiem, który może zostać wyprodukowany w jądrze gwiazdy (cięższe powstają w wyniku kosmicznych kataklizmów - wybuchów supernowych).
Wolne żelazo na Ziemi występuje sporadycznie w postaci drobnych samorodków oraz przybywających na nią meteorytów. Minerały żelaza są za to liczne: hematyt Fe2O3, syderyt FeCO3, magnetyt Fe3O4 czy limonit (uwodnione tlenki, tzw. ruda darniowa) to najczęściej wydobywane rudy tego metalu, natomiast imitujący złoto piryt FeS2 służy do produkcji kwasu siarkowego (5).
Świat ożywiony również skorzystał z dobrodziejstw żelaza, jest ono niezbędne dla wszystkich organizmów. Jony żelaza znajdują się w centrach dwóch ważnych białek: hemoglobiny transportującej tlen i mioglobiny magazynującej życiodajny gaz w mięśniach. Również wiele enzymów odpowiedzialnych za reakcje utleniania i redukcji funkcjonuje dzięki obecności jonów żelaza (wykonując doświadczenia, dowiesz się, dlaczego tak się dzieje). W organizmie dorosłego człowieka znajduje się około 4 gramów żelaza, a jego niedobór powoduje anemię. Bogate źródła łatwo przyswajalnego żelaza to: mięso, wątroba, żółtka jaj, orzechy, mleko i warzywa strączkowe.
Wzajemne przemiany
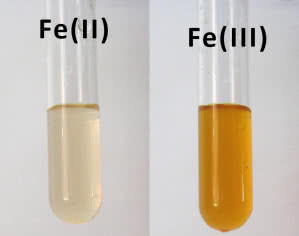
W twoim laboratorium dostępne są sole żelaza dwuoraz trójwartościowego. Przykładem tych pierwszych jest siarczan(VI) FeSO4, natomiast drugich - chlorek FeCl3 (oba w postaci soli uwodnionych). W przypadku FeCl3 zachowaj szczególną ostrożność: jego roztwory są żrące i w pozostawiają trudne do usunięcia, brunatne plamy. Obowiązują więc ochronne rękawice i wykonywanie prób na tacy. Sporządź roztwory obu soli i wlej je do probówek. Roztwór zawierający jony Fe2+ ma jasnozieloną barwę, w przypadku kationów Fe3+ barwa jest żółta (6). Do każdej z probówek dodaj niewielką ilość roztworu wodorotlenku sodu NaOH. W obu przypadkach powstaną osady: Fe(OH)2 ma kolor szarozielony, natomiast Fe(OH)3 - czerwonobrunatny (7).
Do probówki z osadem Fe(OH)2 dodaj kilka kropli 3% roztworu nadtlenku wodoru H2O2 (woda utleniona stosowana jako środek dezynfekcyjny). Osad szybko zmienia barwę na czerwonobrunatną (8):
2Fe(OH)2 +H2O2 → 2Fe(OH)3
Do probówki z wodą wlej kilka kropli roztworu FeCl3 tak, aby barwa była tylko jasnożółta. Dodaj niewielką ilość roztworu jodku potasu KI, co od razu powoduje ściemnienie zawartości. Teraz dodaj roztwór tiosiarczanu sodu Na2S2O3. Zawartość naczynia stała się prawie bezbarwna. Na koniec wlej kilka kropli roztworu NaOH. Powstały osad ma barwę… o dziwo, zielonkawą. Jakie reakcje przebiegły w probówce?
Najpierw jony Fe3+ utleniły jodki do wolnego jodu (ściemnienie roztworu), same oczywiście ulegając redukcji. Dodatek tiosiarczanu spowodował ponowną redukcję jodu do bezbarwnych jodków, a pod wpływem zasady wytrącił się osad Fe(OH)2.
To właśnie łatwe przejście - jakby powiązane z Przemianami Owidiusza - jonów Fe(II) w Fe(III) i na odwrót stanowi podstawę ich aktywności biologicznej.
Najczęściej mówiąc o żelazie, mamy na myśli stal. Czystego żelaza nie używa się prawie nigdzie. Żelazo o niewielkiej ilości domieszek stosowane jest jako materiał magnetyczny (żelazo ARMCO). Stal to stop, w którym zawartość węgla dochodzi do 1,7-2,1%. Jeżeli węgla jest więcej, wydziela się on w postaci grafitu i powstaje żeliwo.
Krzysztof Orliński