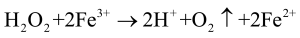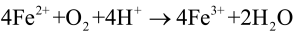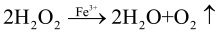Wiek żelaza - część 3
Jednym z eksperymentów w pierwszej części artykułu było utlenianie zielonkawego osadu wodorotlenku żelaza(II) do brunatnego wodorotlenku żelaza(III) przy pomocy roztworu H2O2. Nadtlenek wodoru ulega rozkładowi pod wpływem wielu czynników, m.in. związków żelaza (w doświadczeniu widać było wydzielające się pęcherzyki tlenu). Efekt ten wykorzystasz do pokazania …
…jak działa katalizator
Oczywiście przyspiesza przebieg reakcji, ale - warto pamiętać - tylko takiej, która i bez niego może zachodzić w danych warunkach (choć czasem bardzo wolno, wręcz niezauważalnie). Spotykane jest jednak twierdzenie, że katalizator owszem przyspiesza reakcję, ale sam w niej nie bierze udziału. Hmm…, to po co się go w ogóle dodaje? Chemia to nie magia (niekiedy chyba jednak tak, i to w dodatku "czarna"), a dzięki prostemu eksperymentowi zobaczysz katalizator w akcji.
Najpierw przygotuj stanowisko. Potrzebna będzie taca, aby nie zalać stołu, ochronne rękawice i okulary lub przyłbica. Masz do czynienia ze żrącymi odczynnikami: perhydrolem (30 % roztwór nadtlenku wodoru H2O2) i roztworem chlorku żelaza(III) FeCl3. Postępuj rozsądnie, a zwłaszcza chroń oczy: poparzona pehydrolem skóra dłoni się zregeneruje, ale oko już nie (1).
Do porcelanowej parowniczki wlej 5-10 cm3 perhydrolu i dodaj dwa razy większą objętość wody (reakcja zachodzi również z wodą utlenioną, ale w przypadku 3% roztworu efekt jest słabo widoczny). Otrzymałeś około 10% roztwór H2O2 (handlowy perhydrol został rozcieńczony wodą w stosunku 1:2). Do drugiej parowniczki wlej tylko wodę w takiej ilości, aby w każdym naczyniu było tyle samo cieczy (będzie to twój układ porównawczy). Do obu parowniczek dodaj teraz po 1-2 cm3 10% roztworu FeCl3 i obserwuj uważnie przebieg próby (2).
W parowniczce kontrolnej ciecz ma żółtawą barwę pochodzącą od uwodnionych jonów Fe3+. Natomiast w naczyniu zawierającym nadtlenek wodoru dużo się dzieje: zawartość zmienia barwę na brunatną, intensywnie wydziela się gaz, a ciecz w parowniczce ulega silnemu rozgrzaniu, wręcz wrze. Koniec reakcji zwiastuje ustanie wydzielania gazu i zmiana koloru zawartości na żółty, taki sam, jak w układzie kontrolnym (3). Byłeś właśnie świadkiem działania katalizatora, ale czy wiesz, jakie przemiany zaszły w naczyniu?
Brunatna barwa pochodzi od połączeń żelaza dwuwartościowego, które powstają w wyniku reakcji:
Gaz, który intensywnie wydziela się z parowniczki to oczywiście tlen (możesz sprawdzić, że umieszczone nad powierzchnią cieczy żarzące się łuczywko zacznie płonąć). W dalszym etapie uwolniony w powyższej reakcji tlen utlenia kationy Fe2+:
Zregenerowane jony Fe3+ ponownie biorą udział w pierwszej reakcji. Proces kończy się wraz z wyczerpaniem całej ilości nadtlenku wodoru, co zauważyłeś jako powrót żółtawej barwy zawartości parowniczki. Gdy pomnożysz obie strony pierwszego równania przez dwa i dodasz go stronami do drugiego, a następnie zredukujesz identyczne wyrazy po przeciwnych stronach (jak w zwykłym równaniu matematycznym), otrzymasz równanie reakcji rozkładu H2O2. Zauważ, że nie występują w nim żadne jony żelaza, ale dla zaznaczenia roli, jaką pełnią w przemianie, wpisz je nad strzałką:
Nadtlenek wodoru rozkłada się również samorzutnie według powyższego równania (oczywiście bez udziału jonów żelaza), ale proces ten jest dość powolny. Dodatek katalizatora zmienia mechanizm reakcji na łatwiejszy do realizacji i w konsekwencji przyspiesza całą przemianę. Skąd zatem pogląd, że katalizator nie bierze udziału w reakcji? Zapewne stąd, że zostaje zregenerowany podczas procesu i w mieszaninie produktów znajduje się w niezmienionej postaci (w eksperymencie żółta barwa jonów Fe(III) występuje zarówno przed, jak i po reakcji). Pamiętaj więc, że katalizator uczestniczy w reakcji i jest to udział czynny.
Na kłopoty z H2O2
Enzymy to też katalizatory, ale działające w komórkach organizmów żywych. Przyroda wykorzystała jony żelaza w centrach aktywnych enzymów, które przyspieszają reakcje utleniania i redukcji. Ma to związek ze wspomnianymi już łatwymi zmianami wartościowości żelaza (z II na III i odwrotnie). Jednym z takich enzymów jest katalaza chroniąca komórki przed wysoce toksycznym produktem komórkowych przemian tlenu - nadtlenkiem wodoru. Katalazę uzyskasz łatwo: utrzyj ziemniaka i papkę zalej wodą. Poczekaj, aż zawiesina opadnie na dno i zlej ciecz znad osadu.
Do probówki wlej 5 cm3 ziemniaczanego wyciągu i dodaj 1 cm3 wody utlenionej. Zawartość silnie się pieni, może nawet "wyjść" z probówki, dlatego próbę wykonaj na tacy. Katalaza jest bardzo wydajnym enzymem, w ciągu minuty jedna jej molekuła potrafi rozłożyć nawet kilkanaście milionów cząsteczek H2O2.
Po wlaniu wyciągu do drugiej probówki dodaj 1-2 cm3 roztworu EDTA (sól sodowa kwasu wersenowego) i wymieszaj zawartość. Gdy teraz wlejesz porcję wody utlenionej, nie zaobserwujesz rozkładu nadtlenku wodoru. Powodem jest fakt utworzenia bardzo trwałego kompleksu jonu żelaza z EDTA (odczynnik ten reaguję się z wieloma jonami metali, co jest wykorzystywane do ich oznaczania i usuwania ze środowiska). Połączenie jonu Fe3+ z EDTA zablokowało centrum aktywne enzymu i w konsekwencji unieczynniło katalazę (4).
Żelazna obrączka
W chemii analitycznej identyfikacja wielu jonów opiera się na tworzeniu przez nie trudno rozpuszczalnych osadów. Rzut oka na tabelę rozpuszczalności pozwoli jednak zauważyć, że aniony azotanowe(V) i azotanowe(III) (sole tych pierwszych nazywane są po prostu azotanami, a drugie - azotynami) praktycznie nie tworzą osadów.
Z pomocą w wykrywaniu tych jonów przychodzi siarczan(VI) żelaza(II) FeSO4. Przygotuj odczynniki. Oprócz tej soli potrzebny ci będzie stężony roztwór kwasu siarkowego(VI) H2SO4 i rozcieńczony 10-15% roztwór tego kwasu (uważaj przy rozcieńczaniu, wlewając oczywiście "kwas na wodę"). Do tego sole zawierające wykrywane aniony, np. KNO3, NaNO3, NaNO2. Sporządź stężony roztwór FeSO4 oraz roztwory soli obu anionów (ćwierć łyżeczki soli rozpuść w około 50 cm3 wody).
Odczynniki gotowe, pora na eksperyment. Do dwóch probówek wlej po 2-3 cm3 roztworu FeSO4. Następnie dodaj po kilka kropli stężonego roztworu H2SO4. Pipetą nabierz porcję roztworu azotynu (np. NaNO2) i wlej go tak, aby ściekał po ściance probówki (to ważne!). W ten sam sposób do drugiej próbówki wlej porcję roztworu azotanu (np. KNO3). Jeżeli ostrożnie wlałeś oba roztwory, na powierzchni zauważysz brunatne kółka (stąd zwyczajowa nazwa tej próby - reakcja obrączkowa) (5). Efekt jest ciekawy, ale masz prawo czuć się zawiedziony, być może oburzysz się nawet (To ma być próba analityczna? Wyniki są przecież takie same w obu przypadkach!).
Wykonaj jednak jeszcze jedno doświadczenie. Tym razem do probówek z roztworem soli żelaza(II) dodaj rozcieńczony roztwór H2SO4. Po wprowadzeniu roztworów azotanu i azotynu (tak jak poprzednio) dodatni wynik zauważysz tylko w jednej probówce - tej z roztworem NaNO2. Tym razem nie masz już chyba uwag o przydatności próby obrączkowej: reakcja w słabo kwaśnym środowisku pozwala na jednoznaczne rozróżnienie obu jonów.
Mechanizm reakcji polega na rozkładzie obu typów jonów azotanowych zachodzącym z wydzielaniem tlenku azotu(II) NO (przy okazji utlenia się jon żelaza z dwu- do trójwartościowego). Połączenie jonu Fe(II) z NO jest brunatne i nadaje barwę obrączce (powstaje ona pod warunkiem prawidłowego wykonania próby, mieszając po prostu roztwory otrzymasz tylko ciemne zabarwienie probówki, ale - przyznasz - nie będzie to już tak ciekawy efekt). Rozkład jonów azotanowych wymaga jednak silnie kwaśnego środowiska reakcji, natomiast azotynom wystarczy tylko słabe zakwaszenie - stąd też zaobserwowane różnice w przebiegu próby.
Żelazo w tajnej służbie
Ludzie od zawsze mieli coś do ukrycia. Powstanie pisma spowodowało również rozwój technik zabezpieczenia tak przekazywanej informacji - szyfrowanie lub też ukrycie tekstu. W celu zastosowania tej drugiej metody wynaleziono mnóstwo atramentów sympatycznych. Są to substancje sprawiające, że wykonany nimi napis nie jest widoczny, natomiast ujawnia się pod wpływem np. ogrzewania lub działania inną substancją (wywoływaczem). Sporządzenie atramentu sympatycznego i jego wywoływacza nie jest sprawą skomplikowaną. Wystarczy znaleźć reakcję, w której powstaje barwny produkt. Najlepiej, aby sam atrament był bezbarwny, wtedy wykonany nim napis będzie niewidoczny na podłożu dowolnego koloru.
Związki żelaza również umożliwiają wykonanie atramentów sympatycznych. Po przeprowadzeniu opisanych wcześniej prób jako atramenty sympatyczne można zaproponować roztwory chlorku żelaza(III) FeCl3, rodanku potasu KNCS i żelazocyjanku potasu K4[Fe(CN)6]. W reakcji FeCl3 z rodankiem powstanie czerwone, natomiast z żelazocyjankiem - niebieskie zabarwienie. Jako atramenty lepiej nadają się roztwory rodanku i żelazocyjanku, ponieważ są bezbarwne (w drugim przypadku roztwór musi być rozcieńczony). Napis wykonany żółtawym roztworem FeCl3 jest widoczny na białym papierze (chyba, że kartka też będzie żółta).
Sporządź rozcieńczone roztwory wszystkich soli i przy pomocy pędzelka lub zapałki, wykonaj na kartkach napisy roztworem rodanku oraz żelazocyjanku. Użyj różnych pędzelków do każdego z nich, aby nie zanieczyścić odczynników. Po wyschnięciu załóż rękawice ochronne i zwilż zwitek waty roztworem FeCl3. Roztwór chlorku żelaza(III) jest żrący i pozostawia żółte, brunatniejące z czasem plamy. Z tego powodu unikaj zabrudzenia nim skóry i otoczenia (doświadczenie wykonaj na tacy). Watą dotykaj kartki papieru tak, aby tylko zwilżyć jej powierzchnię. Po wpływem wywoływacza ujawnią się litery napisu: czerwone i niebieskie. Możesz również pisać obydwoma atramentami na jednej kartce, wtedy ujawniony napis będzie dwubarwny (6). Jako niebieski atrament nadaje się również spirytus salicylowy (2% alkoholowy roztwór kwasu salicylowego) (7).
Na tym kończy się trzyczęściowy artykuł poświęcony żelazu i jego związkom. Przekonałeś się, że to ważny pierwiastek, a w dodatku umożliwia wykonanie wielu ciekawych doświadczeń. Jednak pozostaniemy nadal przy "żelaznej" tematyce, ponieważ za miesiąc poznasz jego największego wroga - korozję.
Krzysztof Orliński