Wiek żelaza - część 2
Poprzedni odcinek zakończył się eksperymentami, w których zaobserwowałeś, jak łatwo kationy żelaza zmieniają swoje wartościowości. Przemiana Fe2+ ↔ Fe3+ jest podstawą biologicznej aktywności jonów tego pierwiastka, a także umożliwia wykonanie wielu ciekawych doświadczeń. Nie traćmy zatem czasu.
Chemia żelaza…
…jest bardzo rozbudowana. Metale grup pobocznych (od 3 do 12) tworzą znacznie liczniejsze związki niż metale grup głównych (litowce, berylowce oraz metale z grup od 13 do 15), zwłaszcza kompleksowe, i żelazo nie jest tu wyjątkiem. Metaliczne, czyste żelazo łatwo reaguje z kwasami, ale w stężonym kwasie azotowym zachodzi pasywacja. Terminem tym określa się powstawanie na powierzchni metalu ochronnej warstwy, która chroni go przed dalszym działaniem kwasu. Kluczowa jest czystość żelaza, stopy żelaza zachowują się odmiennie, o czym przekonasz się w jednym z kolejnych artykułów. Żelazo jest za to całkowicie odporne na działanie nawet stężonych roztworów zasad, co umożliwia ich transport w stalowych pojemnikach.
Żelazo w swoich związkach najczęściej przybiera wartościowość II i III (istnieją również połączenia żelaza sześciowartościowego, ale nie znajdziesz ich w domowym laboratorium). Roztwory soli żelaza(II) mają bladozielone zabarwienie, a żelaza(III) - żółte. Również proste sole w stanie stałym są zazwyczaj w podobnych kolorach (1). Z doświadczeń wykonanych w ubiegłym miesiącu wiesz, że Fe(OH)2 był również zielonkawy, ale to efekt szybkiego utleniania pod wpływem powietrza (wodorotlenek otrzymany z czystych substancji w warunkach beztlenowych jest biały), natomiast Fe(OH)3 to brunatnoczerwona substancja, kolorem podobna do rdzy (z którą zresztą ma wiele wspólnego).
Chemia żelaza prezentuje jednak znacznie bogatszą paletę barw, na początek…
…niebieskie reakcje
Chemicy eksperymentowali z najdziwniejszym substancjami. Jeden z nich w początkach XVIII wieku zmieszał kawałki skóry i kopyt bydlęcych z potażem (węglan potasu) i stalowymi opiłkami, po czym zaczął ogrzewanie. Odór, który wydzielał się z tygla, możesz sobie tylko wyobrazić, ale rezultaty były ciekawe. Po zalaniu stopionej masy wodą i odparowaniu roztworu otrzymał kryształy jakiegoś związku. Substancja rozpuszczała się w wodzie i dawała z solami żelaza ciemnoniebieskie zabarwienie. Kolor się spodobał i użyto go do farbowania mundurów pruskiej armii. Jednak szybko ulegał ścieraniu i błękit pruski (tak nazwano barwnik) długo nie zagrzał miejsca w tej roli.
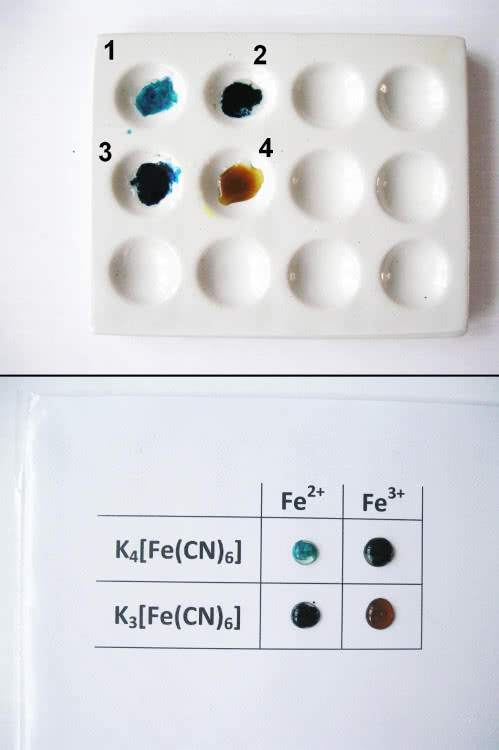
Bohater opowieści to żelazocyjanek potasu K4[Fe(CN)6], związek tworzący żółte kryształy uwodnionej soli (jego nazwa systematyczna brzmi: heksacyjanożelazian(II) potasu). W toku dalszych badań udało się utlenić jon żelaza tkwiący w centrum kompleksu, w ten sposób powstał żelazicyjanek potasu K3[Fe(CN)6]. Sól tworzy czerwone kryształy, a jej nazwa systematyczna to heksacyjanożelazian(III) potasu. Nie pomyl tych dwóch związków, ponieważ eksperymenty się nie udadzą (2).
Sporządź roztwory soli żelaza(II) i żelaza(III) oraz obu heksacyjanożelazianów. Przeprowadź reakcje krzyżowe: niech każda z soli żelaza przereaguje z każdym związkiem cyjankowym. Wyniki prób najłatwiej porównasz ze sobą, wykonując eksperyment na specjalnej płytce porcelanowej z wgłębieniami. Ale możesz również przeprowadzić reakcje kroplowe na folii (mieszasz po kropli roztworu na przezroczystej folii) lub po prostu w probówkach. Opisz tylko naczynia, abyś wiedział, co w którym się znajduje. Niezależnie od sposobu wykonania doświadczenia powinieneś otrzymać następujące wyniki (kolory) (3):
W reakcji 2 powstał wspomniany wyżej błękit pruski, w 3 - również. Może cię to zaskoczyć, ale wzory obu związków są jednakowe: KFe[Fe(CN)6]. Ten pozorny paradoks wyjaśni się, gdy przypiszesz jonom żelaza ich wartościowości: KFeII[FeIII(CN)6] i KFeIII[FeII(CN)6] (stechiometria wzorów się zgodzi). Poza tym jony żelaza w kompleksie i na zewnątrz niego szybko zmieniają wartościowości, stąd też intensywne zabarwienie związku (pochłaniane światło powoduje przeniesienie elektronu z jednego jonu do drugiego). Reakcja 4 przebiega "normalnie" (sam ustal wzór otrzymanego połączenia), natomiast w pierwszej próbie biały osad powstanie tylko w warunkach beztlenowych i z czystych odczynników. Ponieważ sole żelaza(II) łatwo się utleniają, a odczynniki, którymi dysponujesz, nie są zapewne czyste - najprawdopodobniej i w tym przypadku uzyskasz niebieskie zabarwienie. To dowód na czułość reakcji z heksacyjanożelazianami (barwa pojawi się nawet w obecności śladów odpowiednich jonów) - są one jednymi z podstawowych prób analitycznych dla wykrywania żelaza (kolejne poznasz w dalszej części artykułu).
Utrata barwy,…
Do probówki wlej niewielką ilość roztworu chlorku żelaza(III). Przygotuj roztwór fluorku sodu NaF i dodawaj go kroplami do probówki z roztworem soli żelaza. Żółtawa barwa niknie, a ciecz staje się przezroczysta. Zaobserwowałeś właśnie powstawanie fluorkowego kompleksu żelaza(III). W przeciwieństwie do żółtawej barwy uwodnionego jonu Fe3+, tworzący się kompleks fluorkowy jest bezbarwny (4). Reakcja ta ma duże znaczenie analityczne: pozwala na wykrywanie jonów innych metali w obecności żelaza, gdy mogłoby ono swoimi reakcjami utrudniać zauważenie szukanej barwy. Przykładem jest bardzo czuła reakcja jonów Cu2+ z żelazocyjankiem potasu. Brunatny osad żelazocyjanku miedzi nie będzie widoczny, gdy w roztworze znajdą się jony Fe3+, ponieważ powstający błękit pruski spowoduje ciemnoniebieskie zabarwienie roztworu. Jeżeli jednak przed reakcją dodasz roztworu fluorków, zwiążą one jony żelaza, co umożliwi dostrzeżenie barwy pochodzącej od osadu związku miedzi. Taka czynność - często stosowana w analityce chemicznej - to maskowanie.
Podobne działanie odbarwiające ma kwas fosforowy H3PO4. Gdy dodasz go do roztworu soli żelaza(III), żółtawa barwa również zniknie. Kompleksotwórcze działanie jonów fosforanowych wykorzystywane jest w preparatach do usuwania rdzy. Moc kwasu fosforowego wystarcza do rozpuszczenia skorodowanej powłoki oraz trwałego związania jonów żelaza, jednak nie jest dość duża, aby w znaczącym stopniu naruszyć nieuszkodzoną powierzchnię metalu (przeciwdziała temu również dodatek odpowiednich inhibitorów).
…chemiczna krew…
Kolejna interesująca reakcja żelaza(III), a przy okazji ważna próba analityczna dla wykrywania tego kationu. Do probówki z żółtawym roztworem FeCl3 dodaj kroplami roztwór rodanku (tiocyjanianu) potasu KNCS. Od razu zacznie się pojawiać czerwonawe zabarwienie, przechodzące w krwiste przy większej ilości dodanego odczynnika. Efekt pochodzi od powstającego kompleksu: w zależności od wzajemnej proporcji soli żelaza i rodanku tworzą się połączenia od, zawierające od jednego do sześciu, jonów rodankowych (barwa pogłębia się wraz z liczbą anionów NCS - w kompleksie).
Do probówki z krwistą zawartością dodaj niewielką ilość roztworu fluorku sodu. Zabarwienie zniknie, co świadczy o tym, że kompleks fluorkowy jest trwalszy od rodanowego (jony fluorkowe wyparły jony rodankowe z kompleksu). Podobny efekt uzyskasz po dodaniu kwasu fosforowego.
Otrzymane połączenie wykorzystywane jest często w efektach specjalnych jako imitacja krwi. Posmaruj skórę dłoni roztworem rodanku potasu, a ostrze noża roztworem chlorku żelaza(III). Po przyłożeniu noża do skóry (uważaj, abyś naprawdę się nie skaleczył!) spod jego ostrza zaczyna spływać "chemiczna krew" (5). Efekty tego nieco makabrycznego eksperymentu usuniesz, po prostu myjąc dłonie. Trwałe zabrudzenia solami żelaza zlikwidujesz za pomocą roztworu kwasu szczawiowego lub szczawianu potasu (one również wchodzą w skład odrdzewiaczy).
…i atrament
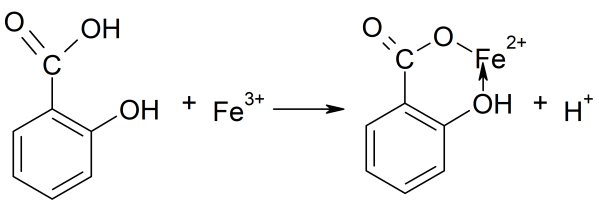
Spirytus salicylowy to środek odkażający, który nabędziesz w każdej drogerii i aptece. Specyfik jest 2% alkoholowym roztworem kwasu salicylowego. Do probówki nalej 2-3 cm3 roztworu FeCl3 i dodaj spirytus salicylowy. Już pierwsze krople odczynnika wywołają niebieskofioletowe zabarwienie roztworu, które pochodzi od tworzącego się chelatu (z gr. chele - kleszcze):
Ciecz w probówce przypomina kolorem atrament (6). Nie jest to przypadek: inkaust (jak dawniej nazywano atrament) był wytwarzany ze związku o budowie zbliżonej do kwasu salicylowego. Związkiem tym jest kwas galusowy występujący w galasach - naroślach na liściach dębu i buka, wywołanych obronną reakcją rośliny na uszkodzenia powodowane przez owady. Wspólnym elementem strukturalnym cząsteczek obu kwasów jest grupa OH połączona bezpośrednio z pierścieniem benzenowym. Związki o tej budowie to fenole, tworzące z jonami żelaza(III) połączenia o ciemnym zabarwieniu. Podobną ciemną barwę otrzymasz, gdy do probówki z roztworem FeCl3 dodasz kilka kropli naparu z herbaty (tym razem reaguje tanina - połączenia glukozy i kwasu galusowego).
Żelazo? Smacznego!
Żelazo to nie tylko stal i żeliwo. Związki tego metalu znalazły zastosowanie w różnych dziedzinach. Chlorek żelaza(III) służy m.in. do trawienia płytek drukowanych. Wiesz już, że żelazo jest ważnym biopierwiastkiem, który musi być dostarczony z pożywieniem. Jego związki to także dopuszczone dodatki do żywności z listy E. Pod numerem E172 znajdują się na niej tlenki i wodorotlenki żelaza, będące barwnikami: czarnym, brązowym, czerwonym, pomarańczowym i żółtym (w zależności od składu). Stosowane są m.in. do nadawania koloru mięsu łososiów, wędlinom, a także wyrobom cukierniczym. Również kapsułki leków zawdzięczają swe barwy tlenkom żelaza. Pod numerami E535, E536 i E538 kryją się żelazocyjanki (sodu, potasu i wapnia). Są one środkami przeciwdziałającymi zbrylaniu, np. soli kamiennej. Ich obecność na liście E świadczy o trwałości kompleksu cyjankowego tak dużej, że szkodliwe jony CN– nie są z niego uwalniane. Glukonian E579 i mleczan E585 żelaza to z kolei regulatory kwasowości, środki chroniące kolory i suplementy diety (7).
Przed nami jeszcze jeden odcinek poświęcony żelazu i jego związkom. Mogę zapewnić, że zaproponowane w nim doświadczenia jak zwykle nie wymagają trudno dostępnych odczynników, natomiast będą ciekawe i pozwalające lepiej zrozumieć chemię.
Zobacz także:
Dynastia metalurgów z Coalbrookdale
Wzorzec metaliczności część 1 - najlżejszy
Wzorzec metaliczności, część 2 - najważniejsze
Wzorzec metaliczności, część 3 - cała reszta