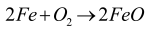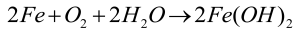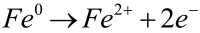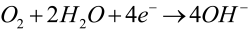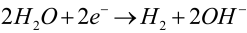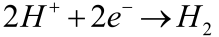Niszczycielka - część 1

Ale korozja stali, bo ta jest najczęstsza, to nie tylko łuszcząca się powierzchnia i rudobrązowe naloty na niej. To wróg niosący śmierć i zniszczenie. Nie sądź, że autor popadł w przesadę. Urwany wał korbowy silnika, dziurawy kadłub statku, osłabiona ściana zbiornika ciśnieniowego czy też unieruchomione hamulce = gotowy przepis na katastrofę. Do tego drobne niedogodności dnia codziennego: skorodowany łańcuch rowerowy i zapieczone śruby (1). Korozja powoduje gigantyczne koszty, rocznie czwarta część wyprodukowanej stali ulega tytułowej niszczycielce. Nie ma wyjścia, chemik musi dobrze poznać wroga.
Oblicza korozji
Na początku należy odpowiedzieć na pytanie: czy metale muszą korodować? Niestety tak, naturalnym stanem większości metali jest stan utleniony, czyli przebywanie w postaci związków chemicznych (jednym z wyjątków jest złoto). Dużym nakładem pracy i kosztów ludzie wydobywają je z rud, ale potem do głosu dochodzą prawa natury i metale starają się wrócić do swojego stanu naturalnego. Dlatego metale muszą korodować, a rolą specjalistów (i nas samych jako użytkowników) jest spowolnienie tego procesu.
Korozja to ogólne pojęcie niszczenia materiałów konstrukcyjnych, nie tylko samych metali (mówimy np. o korozji betonu). Jednak w przypadku tych ostatnich, a zwłaszcza stali, jest ona najgroźniejsza, ze względu na powszechność stosowania. Wśród kilku typów korozji można wyróżnić korozję chemiczną, czyli reakcje z gazami atmosferycznymi i wodą. W przypadku żelaza jest to tworzenie tlenku (w suchej atmosferze):
lub wodorotlenku w obecności wilgoci:
Korozja innych metali przebiega podobnie i zazwyczaj kończy się na tym etapie, a utworzony na powierzchni tlenek, wodorotlenek lub węglan chronią głębsze warstwy metalu. Żelazo jest inne. Po pierwsze dość łatwo utlenia się do związków trójwartościowych, a po drugie produkty utleniania nie są ściśle związane z podłożem, lecz odstają od niego (na pewno widziałeś łuszczącą się rdzę) i odsłaniają nowe fragmenty powierzchni metalu, wystawiając go na dalsze niszczenie.
Wiadomo, że ogrzewanie zwiększa szybkość zachodzenia przemian chemicznych. W wysokich temperaturach metale ulegają korozji gazowej, czyli reakcji z różnymi gazami, nie tylko z tlenem, ale np. z azotem, tlenkiem węgla czy wodorem.
Wnikanie gazów do wnętrza metalu zmienia jego właściwości i może stać się przyczyną osłabienia konstrukcji. Szczególnie groźna jest korozja wodorowa, ponieważ atomy wodoru (najmniejsze z atomów, co ułatwia ich wnikanie) dosłownie rozsadzają strukturę metalu. Korozja gazowa to głównie problem przemysłu chemicznego, ale jej działanie możesz dostrzec w postaci niebieskawych obszarów pojawiających się na elementach spawanych lub na palnikach kuchenki gazowej (2). Co ciekawe, korozja gazowa w pewnych przypadkach jest stosowana celowo (patrz: Korzyści z korozji).
Metale są również atakowane przez mikroorganizmy, a ściślej wytwarzane przez nie produkty przemiany materii. Najszkodliwsze z nich to siarczki i siarkowodór, który daje radę nawet stali nierdzewnej. Do listy zagrożeń dołącza więc i korozja biologiczna.
Jak zdążyłeś się przekonać, korozja ma niejedno oblicze. Jednak najgroźniejsze z nich, niosące prawdziwe zniszczenie, dopiero przed nami.
Wielkie żarcie
Termin korozja pochodzi od łacińskiego słowa corrosio, co znaczy "zżerać". Pozostając przy "kulinarnych" porównaniach: o ile przedstawione wyżej rodzaje korozji chemicznej jedynie "liżą" powierzchnie metali, o tyle korozja elektrochemiczna dosłownie je pochłania.
Dlaczego kolejną odmianę nazywa się elektrochemiczną? Czyste żelazo, korodujące stosunkowo powoli, nie jest używane jako materiał konstrukcyjny. Natomiast stopy - różne gatunki stali i żeliwa - muszą zawierać nieodzowny dodatek węgla. Kryształy grafitu oraz cementytu Fe3C tworzą jednak z żelazem ogniwa galwaniczne. W obecności elektrolitu (np. woda wraz z rozpuszczonymi gazami i solami) obwód zostaje zamknięty, prąd płynie i zaczynają zachodzić niekorzystne procesy. Ich szybkość jest nieporównywalnie większa niż w przypadku korozji chemicznej, stąd tytuł rozdziału wcale nie stanowi przesady.
Anodą (patrz: Anoda i katoda) w powstających ogniwach galwanicznych jest żelazo, które utlenienia się do dwudodatnich kationów: (A)
Na drugiej elektrodzie (grafit lub cementyt) mogą zachodzić różne reakcje. Najczęściej jest to katodowa redukcja tlenu rozpuszczonego w wodzie: (K1)
lub (gdy tlenu brakuje) wody: (K2)
Jeżeli środowisko jest zakwaszone, redukują się także jony wodorowe: (K3)
W rzeczywistości przebiegają wszystkie trzy procesy katodowe, w stopniu zależnym od składu elektrolitu, temperatury i innych czynników. Zapamiętaj, że na anodzie następuje niszczenie żelaza, natomiast środowisko wokół katody staje się bardziej zasadowe (3).
Jeżeli dodasz stronami równania reakcji A i K1 (w pierwszej z nich dwukrotnie zwiększ współczynniki w celu zbilansowania liczby elektronów), otrzymasz równanie identyczne z zapisem powstawania wodorotlenku żelaza z poprzedniego rozdziału (jony Fe2+ i OH- wytrącą osad tego związku). Przemiany zachodzące w ogniwach są takie same, jak przebiegające w probówce. Różnicą jest rozdzielenie w przestrzeni procesów utleniania i redukcji. W kolejnych reakcjach (już tylko chemicznych) powstaje mieszanina wodorotlenków, uwodnionych tlenków i węglanów żelaza, czyli brunatnoczerwona rdza.
Poznać wroga
Już w VI wieku p.n.e. chiński mędrzec Sun Tzu w traktacie "Sztuka wojny" podkreślał, że elementem niezbędnym do odniesienia zwycięstwa jest dobra znajomość przeciwnika. Zanim więc zajmiesz się metodami przeciwdziałania korozji, poznaj czynniki, które ją powodują i przyspieszają. Pomoże ci w tym oczywiście doświadczenie, w dodatku bardzo proste i niewymagające właściwie żadnych profesjonalnych odczynników czy wyposażenia.
Te dwa pojęcia często sprawiają trudności. Ogólnie anoda to elektroda, którą prąd dopływa do układu, katoda natomiast odprowadza go na zewnątrz. W układach elektrochemicznych anoda jest elektrodą, na której zachodzi utlenianie, czyli oddawanie elektronów (przyjęto, że kierunek prądu jest zgodny z ruchem ładunków dodatnich, więc elektrony poruszają się "pod prąd"). Na katodzie ma miejsce redukcja, czyli przyjmowanie elektronów.
Wiedząc, że na anodzie elektrony są odbierane z układu, a na katodzie przekazywane do niego, nie będziesz już miał trudności w określeniu znaków elektrod. W ogniwie (reakcje zachodzą samorzutnie) anoda jest ujemna, a katoda dodatnia. W elektrolizerze zewnętrzne źródło prądu wymusza reakcje, a znaki elektrod są przeciwne.
Przygotuj sześć probówek, sześć zwykłych stalowych gwoździ, miedziany drut, cynkową blaszkę, wodę destylowaną, chlorek sodu NaCl, wodorotlenek sodu NaOH i kwas octowy CH3COOH. Jeżeli zupełnie nie posiadasz sprzętu laboratoryjnego, zamiast probówek użyj małych słoiczków.
Wodę destylowaną (lub demineralizowaną) dostaniesz w sklepach i na stoiskach z akcesoriami motoryzacyjnymi, w ostateczności stop nieco szronu z zamrażarki. Chlorek sodu to nic innego jak sól kamienna, 10% roztwór kwasu octowego to zwykły ocet spożywczy, a zamiast wodorotlenku sodu możesz użyć środka do udrażniania rur (związek wchodzi w jego skład). Drut miedziany zdobędziesz bez trudu, a cynkową blaszkę uzyskasz z rozbiórki ogniwa Leclanchego.
Dokładnie oczyść i odtłuść powierzchnie metali. Jeden z gwoździ owiń drutem miedzianym, a drugi paskiem cynkowej blaszki. Włóż gwoździe do probówek, ponumeruj naczynia i nalej do nich (część gwoździa musi wystawać nad powierzchnię cieczy) (4):
- : wodę destylowaną.
- : około 3% roztwór chlorku sodu (chlorki są czynnikami sprzyjającymi korozji). Roztwór nie musi być przygotowany z aptekarską dokładnością, wystarczy, że rozpuścisz pół łyżeczki soli w połowie szklanki wody z kranu.
- : około 3% roztwór wodorotlenku sodu (uwagi dotyczące sporządzenia jak wyżej).
- : około 3% roztwór kwasu octowego (porcję handlowego 10% octu rozcieńcz dwukrotnie większą objętością wody).
- : około 3% roztwór chlorku sodu, w tym naczyniu gwóźdź jest połączony z blaszką cynkową.
- : około 3% roztwór chlorku sodu, natomiast gwóźdź jest owinięty drutem miedzianym.
Probówki odstaw na 48 godzin. Doświadczenia z korozją wymagają cierpliwości. Korozja elektrochemiczna zachodzi błyskawicznie w porównaniu z chemiczną, jednak efekty nie są tak szybkie jak wytrącanie osadów. Po dwóch dniach (lub później) stwierdzisz następujące rezultaty (5):
- : jasnożółte zabarwienie roztworu, na dnie nieco brunatnego osadu.
- : żółtobrunatny roztwór, na dnie brunatny osad.
- : brak oznak korozji.
- : gwóźdź "nadgryziony" przez kwas, ale roztwór jest bezbarwny, brak osadu. Jeżeli zobojętnisz nadmiar kwasu wodorotlenkiem, w probówce wytrąci się osad barwy zielonkawej (możesz zauważyć brunatną domieszkę) (6).
- : brak oznak korozji, na dnie nieco białego osadu.
- . żółtobrunatny roztwór, na dnie duża ilość brunatnego osadu.
Tytuł brzmi paradoksalnie, ale jest prawdziwy. W pewnych przypadkach zachodzenie korozji rzeczywiście przynosi korzyści. Na powierzchni niektórych metali (np. glinu, chromu czy cynku) powstają szczelne powłoki tlenków, które chronią głębsze warstwy przed dalszym niszczeniem. Zjawisko to określane jest jako pasywacja. Czasem specjalnie wytwarza się pasywne powłoki na metalach, a przykładem jest anodowanie przedmiotów aluminiowych, w przypadku których powłoka tlenkowa może zostać trwale zabarwiona (7).
Stal także skorzysta z dobrodziejstw korozji. Stosowane w jej przypadku procesy to azotowanie i nawęglanie. W obu z nich tworzy się powierzchniowa warstwa wzbogacona w azot lub węgiel, twarda i odporna na ścieranie. Od dawna stosowano ciemnienie powierzchni stali, np. przez ogrzewanie w oleju. W takiej czarno barwionej zbroi na XV-wiecznych polach bitew postrach budził rycerz Zawisza z Grabowa, zwany Czarnym.
Stosuje się również postarzanie w celach zdobniczych wyrobów z miedzi i srebra. W pierwszym przypadku na powierzchni metalu wytwarzana jest zielonkawa patyna (uwodnione tlenki i węglany), w drugim - ciemny siarczek.
Jakie jest wytłumaczenie dokonanych obserwacji? Popatrz na równania reakcji zapisane w tekście i spróbuj sam wyciągnąć wnioski. Rozwiązanie za miesiąc.
Krzysztof Orliński