Te, które tworzą sole, część 5 Jod

Dlaczego? Umożliwia wykonanie wielu doświadczeń, do których nie potrzebujesz skomplikowanej aparatury i trudno dostępnych odczynników, a efekty prób zaskoczą Cię barwami (związki pozostałych fluorowców były zazwyczaj białe). Ponadto jod jest najbezpieczniejszym w użyciu członkiem rodziny z powodu mniejszej - w porównaniu do lżejszych pierwiastków grupy 17 - aktywności oraz stałego stanu skupienia.
Pierwiastek z popiołów
W początkach XIX wieku potaż (węglan potasu K2CO3) otrzymywano m.in. z popiołu powstałego ze spalenia wodorostów morskich. Ten zaś związek używany był do produkcji saletry potasowej KNO3, strategicznego materiału niezbędnego do wytwarzania czarnego prochu (w Europie trwały wtedy wojny napoleońskie). Jednym z fabrykantów tej substancji był Francuz Bernard Courtois. W lecie 1812 r. zauważył, że ługi warzelnicze (pozostałości po wymyciu potażu wodą; od ługowania, czyli wypłukiwania substancji stałej przy pomocy rozpuszczalnika) niszczą miedziane kotły, w których ogrzewano popiół z wodą. Courtois pobrał porcję roztworu i zalał ją stężonym kwasem siarkowym(VI). Zaczęły wydzielać się fioletowe opary, które następnie kondensowały w postaci ciemnych kryształów. Zaintrygowany obserwacjami, rozpoczął eksperymenty, ale nie potrafił dociec natury otrzymanej substancji. W końcu Courtois zawiadomił innych chemików o odkryciu.
Doniesienie paryskiego fabrykanta saletry sprawdzał m.in. Joseph Gay-Lussac, który kilkanaście lat później dokładnie zbada i nazwie kolejny fluorowiec - brom (patrz poprzedni odcinek). Gay-Lussac dowiódł, że jod jest pierwiastkiem o analogicznych do chloru właściwościach i nadał mu nazwę pochodzącą od greckiego słowa ioeides, czyli fioletowy (1).
Badaniem jodu zajmował się również angielski chemik sir Humphry Davy, a wykonane doświadczenia pomogły w udowodnieniu, że chlor jest pierwiastkiem, a nie tlenkiem (patrz drugi odcinek cyklu).
Jod w nas i wokół nas
Wyodrębnienie jodu z popiołu morskich roślin nie było przypadkiem. Pierwiastek ten w świecie ożywionym odgrywa bardzo ważną rolę, zarówno dla roślin, jak i zwierząt. U człowieka wchodzi w skład hormonów tarczycy regulujących metabolizm. Jego zawartość w glebie (a co za tym idzie także w pożywieniu i wodzie pitnej) zależy od odległości danego rejonu od morza: im dalej, tym jodu jest mniej. W celu uniknięcia chorób związanych z niedoborem tego pierwiastka stosuje się suplementację preparatami dodawanymi do soli i mąki. Najbogatszym naturalnym źródłem jodu są morskie ryby i owoce morza.
Jod należy do pierwiastków rzadkich. W większych ilościach występuje w wodzie morskiej, niektórych solankach oraz jako domieszka w saletrze chilijskiej, czyli azotanie(V) sodu NaNO3 (w tym minerale znajduje się w postaci soli kwasów tlenowych - jodanów). Pierwszy etap produkcji wolnego jodu zależy od źródła pochodzenia: w przypadku solanek stosuje się utlenianie zawartych w nim jodków (działając chlorem, tak jak przy produkcji bromu), natomiast jodany z saletry są redukowane. Wydzielony pierwiastek wyodrębnia się z mieszaniny reakcyjnej przez ekstrakcję odpowiednio dobranym rozpuszczalnikiem, a następnie oczyszcza przez sublimację i resublimację. Są to zjawiska, które zauważył sam odkrywca, a polegają na przejściu ciała stałego w parę z pominięciem fazy ciekłej (sublimacja) oraz na zestaleniu par bezpośrednio w ciało stałe (resublimacja) (2).
Po co nam jod?
Na przykład do wytwarzania hormonów tarczycy stosowanych w przypadku jej niedoczynności, a promieniotwórczy izotop jod-131 służy do diagnostyki i leczenia schorzeń tego gruczołu. Jodyna to roztwór jodu w alkoholu etylowym, używany jako preparat dezynfekujący, podobne zastosowanie ma jodoform CH3I. Jodek srebra był składnikiem emulsji światłoczułych w klasycznej fotografii, obecnie służy do tzw. zasiewania chmur. Polega ono na rozpylaniu AgI, na którego kryształach kondensuje para wodna, spadająca później w postaci deszczu. W ten sposób można wywołać opady w rejonach dotkniętych suszą lub zlikwidować chmury, gdy nie są one potrzebne (np. przed defiladą w święto państwowe).
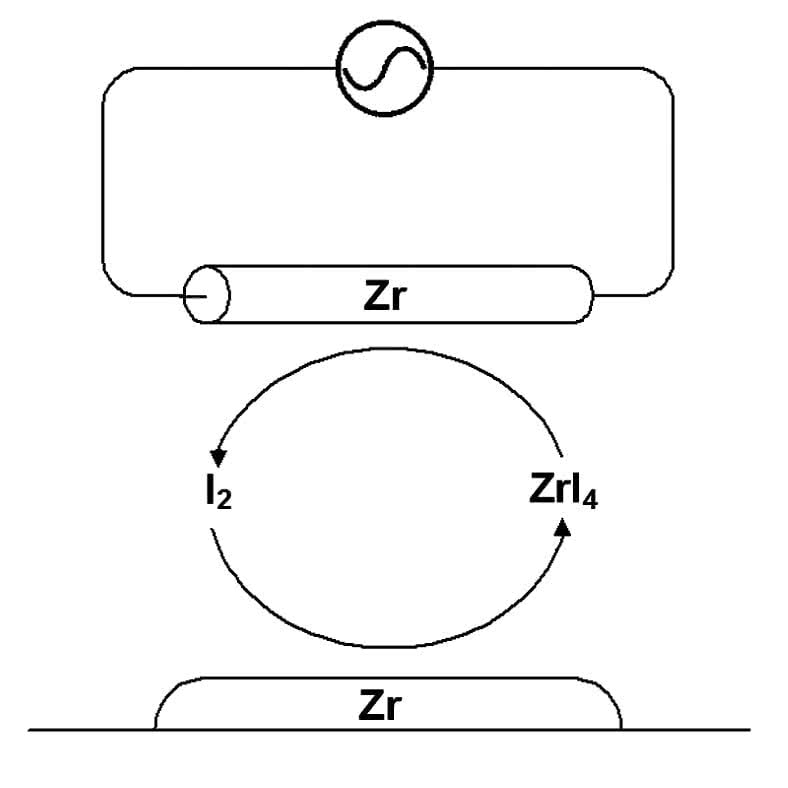
Wolny jod służy do otrzymywania i oczyszczania trudno topliwych metali. Metoda opracowana przez holenderskich chemików Antona van Arkela i Jana de Boera w roku 1925 polega na ogrzewaniu uzyskanego z rudy proszku metalu z parami jodu. Tworzący się lotny jodek ulega rozkładowi na spirali grzejnej, która po pewnym czasie zamienia się w pręt czystego metalu (3).
Metoda została wykorzystana także w konstrukcji żarówek halogenowych. Dodatek jodu zapobiega nieuchronnemu rozpylaniu żarnika (utworzony związek rozkłada się na wolframowej spirali), co sprawia, że żarówka pracuje w wyższej temperaturze i ekonomiczniej wykorzystuje energię elektryczną.
W laboratoriach chemicznych jod jest stosowany do oznaczania substancji o charakterze redukującym, a jodek potasu - utleniającym. W obu przypadkach wykorzystuje się znaną Ci zapewne reakcję jodu ze skrobią, czyli tworzenie połączenia o ciemnoniebieskiej barwie, widocznej nawet w przypadku bardzo małych stężeń chlorowca. Ten fakt zaś sprawia, że oznaczenia jodometryczne należą do najczulszych metod analitycznych. Reakcja jodu ze skrobią jest również powszechnie używana do badania produktów spożywczych (4).
I znów analityka
Podobnie jak w poprzednich odcinkach cyklu o fluorowcach, pora na metody wykrywania bohatera bieżącego artykułu.
Dla jodków podstawowy sposób to reakcja z roztworem azotanu(V) srebra, czyli analogicznie jak w przypadku chlorków i bromków. AgNO3 jest odczynnikiem grupowym do wykrywania anionów - kilka daje podobny wynik reakcji, a dopiero potem identyfikuje się każdy z nich oddzielnie. Rodzinne podobieństwo sprawia, że aniony chlorowców zachowują się w zbliżony sposób (fluoru już nie): tworzą osad, który ulega rozkładowi pod wpływem światła. W przypadku jodków osad ma wyraźną żółtawą barwę, ciemniejszą niż AgBr (AgCl jest biały). Jodek srebra nie rozpuszcza się w rozcieńczonym roztworze amoniaku, co odróżnia go od dobrze rozpuszczalnego AgCl i słabo rozpuszczalnego AgBr. Jednak jodki dają o wiele większą i barwniejszą paletę osadów (5):
· żółty z jonami Pb2+,
· pomarańczowoczerwony z jonami Hg2+,
· brunatny z jonami Bi3+.
W każdym z tych przypadków unikaj nadmiaru odczynnika, ponieważ tworzą się rozpuszczalne połączenia kompleksowe.
Pamiętaj o zachowaniu środków ostrożności podczas prób ze związkami ołowiu i rtęci.
Oczywiście te same reakcje służą również do wykrywania odpowiednich kationów. Często do tego celu przygotowuje się papierki jodkowe, czyli paski bibuły nasycone roztworem KI i wysuszone. Barwne plamy powstałe po naniesieniu kropli roztworu dowodzą obecności szukanych jonów.
Interesująco przebiegają reakcje jodków z jonami Cu2+ i Fe3+. W obu przypadkach otrzymasz brunatne zabarwienie, które pochodzi od wolnego jodu. Możesz go wykryć przy pomocy wskaźnika skrobiowego (patrz ramka: Detektor jodu) lub papierków jodoskrobiowych przygotowanych wg przepisu z drugiego odcinka cyklu. W obu przypadkach jony metali redukują swój stopień utlenienia o jeden, a miedź dodatkowo tworzy osad (połączenie żelaza jest rozpuszczalne; spróbuj sam napisać równania reakcji). Osad związku miedzi jest maskowany barwą jodu, ale i na to znajdzie się rada. Do probówki dodawaj kroplami roztwór tiosiarczanu sodu Na2S2O3, co spowoduje, że ciemna barwa zniknie i zobaczysz biały osad (6).
Zapamiętaj reakcję z tiosiarczanem - jest ona stosowana do usuwania wolnego jodu:
I2+2Na2S2O3→2NaI+Na2S4O6
Tiosiarczan sodu analogicznie reaguje z chlorem i bromem, stąd potoczna nazwa tego związku - antychlor (używa się go do eliminacji resztek chloru po bieleniu). Można jednak powiedzieć, że tiosiarczan to również "antyjod".
Jak w przypadku pozostałych chlorowców, jodki wykryjesz, utleniając je do wolnego pierwiastka (tak zrobiłeś w reakcjach z jonami Cu2+ i Fe3+). Przemiana ta zachodzi bardzo łatwo, nawet pod wpływem tlenu z powietrza. Z tego też powodu jod do soli kuchennej i mąki dodaje się w postaci jodanów (czyli już utlenionej), a nie jodków (powstający wolny jod ulotniłby się z produktu). Do próby potrzebne będą roztwory: jodku potasu KI, nadmanganianu potasu KMnO4, kwasu siarkowego(VI) H2SO4 - oraz rozpuszczalnik organiczny niemieszający się z wodą (np. rozcieńczalnik do farb). Roztwór jodku zakwaś, a następnie kroplami dodawaj roztwór nadmanganianu. Zawartość naczynia przybiera ciemnobrązową barwę:
2KMnO4+10KI+8H2SO4→2MnSO4+6K2SO4+5I2+8H20
Wlej niewielką ilość rozpuszczalnika i dokładnie zmieszaj zawartość. Po rozwarstwieniu cieczy zauważysz, że woda stała się znacznie jaśniejsza, a warstwa organiczna - ciemna od rozpuszczonego w niej jodu (7).
Złoty deszcz
W ostatnim eksperymencie pamiętaj o zachowaniu zasad laboratoryjnego BHP podczas pracy ze związkami ołowiu.
Przygotuj kilkuprocentowe roztwory: dobrze rozpuszczalnej soli tego metalu (azotanu lub octanu) oraz jodku potasu. Do kolby z roztworem związku ołowiu wlej porcję roztworu KI (unikaj nadmiaru, bo powstały osad się rozpuści). Wytrącony żółty PbI2 jest łatwiej rozpuszczalny w gorącej wodzie i po wstawieniu kolby do naczynia z wrzątkiem lub ogrzaniu jej płomieniem palnika, osad znika, a roztwór staje się tylko lekko żółtawy.
Pozostaw kolbę do ostygnięcia, usiądź wygodnie i obserwuj spektakl. Wkrótce zaczynają się pojawiać kryształy w postaci złocistych blaszek, a gdy oświetlisz naczynie z boku, zobaczysz padający "złoty deszcz" (8).
Zamieszanie zawartości kolby wywoła zimową zamieć z nietypowymi - złocistymi - płatkami śniegu.
Detektor jodu Skrobia jest nadzwyczaj czułym odczynnikiem do wykrywania wolnego jodu. Ciemnoniebieska barwa powstającego połączenia to efekt "wchodzenia" jodu do wnętrza spiral tworzonych przez jeden ze składników skrobi - amylopektynę. Kolor zobaczysz nawet w przypadku użycia suchej mąki, ale lepiej przygotować wskaźnik skrobiowy, czyli po prostu rzadki krochmal. Krótko: na koniec noża nabierz szczyptę mąki ziemniaczanej i rozrób ją w kilku cm3 zimnej wody. Zagotuj 100 cm3 wody, a gdy zacznie wrzeć - wlej papkę skrobiową. Pogotuj kilka minut, aż roztwór stanie się przezroczysty. Po ostudzeniu wskaźnik możesz przechowywać w lodówce, ale jest nietrwały i lepiej sporządzać go w miarę potrzeby.
Krzysztof Orliński