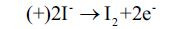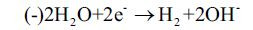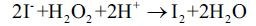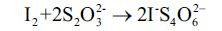Te, które tworzą sole, część 6. Jodowe eksperymenty

Zagubiony biegun
Jak rozróżnić bieguny źródła prądu stałego, jeśli oznaczenia na nim się zatarły i nie masz pod ręką miernika? Z pomocą przychodzi bohater dzisiejszego artykułu oraz… ziemniak.
Powierzchnię przeciętego kartofla zwilż roztworem jodku potasu KI o kilkuprocentowym stężeniu i połóż na niej końce przewodów połączonych z biegunami źródła prądu (np. baterii, pod żadnym pozorem nie używaj źródła o napięciu wyższym niż kilka woltów!).
Wokół jednego z nich od razu zaczyna się tworzyć ciemna plama, rozrastająca się stopniowo wokół końca kabelka. Do którego bieguna jest on podłączony?
Barwna obwódka w pobliżu miejsca zetknięcia przewodu z powierzchnią bulwy to jod, który w charakterystyczny sposób barwi skrobię zawartą w ziemniaku. Oczywiście powstał on z anionów jodkowych I–, które z kolei dążą do bieguna dodatniego:
Rozpoznałeś zatem "plus" źródła. Drugi koniec przewodu, wokół którego nie widać było zmian, to "minus". Użycie papierków jodoskrobiowych (o ich przygotowaniu przeczytasz w drugim odcinku cyklu) również pozwoli rozpoznać biegun dodatni.
A czy dla bieguna ujemnego da się dobrać reakcję przebiegającą z barwnym efektem, aby przy końcach obu przewodów utworzyły się kolorowe plamy? Najpierw spójrz na równanie procesu przebiegającego w okolicy "minusa":
Powstają w niej jony wodorotlenkowe, czyli pobliski obszar przybiera odczyn zasadowy. Jaki popularny odczynnik pozwoli stwierdzić ten fakt?
Oczywiście fenoloftaleina. Sporządź ponownie roztwór jodku potasu i dodaj do niego niewielką ilość 1% alkoholowego roztworu fenoloftaleiny (wskaźnik słabo rozpuszcza się w samej wodzie). Przygotowaną mieszaniną polej powierzchnię ziemniaka (wykorzystaj bulwę z poprzedniej próby, odkrawając zabarwiony płat) i przyłóż końce przewodów. Czerwony kolor wskaże, który biegun jest ujemny (1).
Możesz wykonać paski do sprawdzania biegunowości. Wystarczy, że nasączysz bibułę wykonanym roztworem, a po wysuszeniu potniesz ją na kawałki. Gdy będziesz chciał przeprowadzić doświadczenie, zwilż pasek i przyłóż do niego końce przewodów.
Barwne plamy na bibule potwierdzą znaki zacisków źródła napięcia. Papierki przechowuj szczelnie zamknięte. Po pewnym czasie paski mogą ściemnieć, co jest spowodowane utlenianiem jodków tlenem z powietrza. Zaradzić temu można przez dodatek minimalnej ilości tiosiarczanu sodu Na2S2O3 do roztworu użytego do nasączenia bibuły.
Z poprzedniego odcinka wiesz, że tiosiarczan to "zmiatacz" wolnego jodu. Jednak ilość dodanego odczynnika musi być naprawdę niewielka - tyle tylko, aby zapobiegła ciemnieniu papierków, ale nie zamaskowała oczekiwanego efektu.
Pisak na prąd
Zaadaptuj wykonane próby do konstrukcji "elektrycznego pisaka". Starannie oczyść powierzchnię kawałka blachy. Z kartki papieru wytnij fragment o rozmiarach nieco mniejszych od metalowej podkładki, którą właśnie wyczyściłeś. Najlepiej użyć papieru do drukarek lub ksero, ponieważ po zmoczeniu bibuła jest mało wytrzymała mechanicznie.
Kartkę pociągnij kilkuprocentowym roztworem jodku potasu z dodatkiem wskaźnika skrobiowego, a następnie połóż ją na blaszce. Całość umieść na tacy tak, aby uniknąć zalania stołu. Metalową podkładkę połącz z ujemnym biegunem źródła (wystarczy płaska bateria o napięciu 4,5 V), a biegun dodatni - z metalowym pręcikiem w izolacji, ale usuń osłonę z jego końca.
Gdy teraz powoli będziesz przesuwał "elektryczny pisak" po powierzchni papieru, ukażą się granatowe litery. Napis tworzy się w wyniku reakcji wolnego jodu (wydzielonego wokół końca metalowego pręcika połączonego z plusem źródła) ze skrobią. Napis na kartce pozostaje po jej wyschnięciu (2).
jodu.
Inne kolory tuszy do pisma elektrolitycznego (tak nazywa się to doświadczenie) otrzymasz, używając wskaźników pH. Elektrolitem w tym przypadku będzie 5-10% roztwór Na2SO4 lub KNO3 z dodatkiem wybranego indykatora. W pobliżu elektrody ujemnej roztwór przybiera odczyn zasadowy, a dodatniej - kwasowy. Ta informacja powinna ci ułatwić odpowiednie połączenie biegunów źródła napięcia z płytką i pisakiem oraz dobór właściwego wskaźnika.
Woda jodowa
W czwartym odcinku cyklu wykonałeś doświadczenia z wodą bromową, czyli roztworem bromu w wodzie. Istnieje również woda jodowa, ale jej zastosowanie jest znacznie mniejsze. Po pierwsze: jod nie wchodzi w reakcje tak łatwo jak brom, a po drugie: stężenie jodu w wodzie jest naprawdę niewielkie (patrz: Jak rozpuszcza się jod?). Na plus wody jodowej należy zaliczyć fakt, że jest znacznie bardziej bezpieczna w użyciu niż roztwór bromu.
Wodę jodową można otrzymać, zalewając kryształki jodu wodą i często mieszając zawartość naczynia. Jednak otrzymanie nasyconego roztworu trwa dosyć długo (3). Lepiej więc wytworzyć odczynnik innym sposobem i od razu użyć do prób. Metody są dwie: utlenianie jodków oraz elektroliza ich roztworu. Oba sposoby poznałeś przy okazji doświadczeń z wodą bromową. W skrócie:
- do roztworu jodku potasu KI dodaj kilka kropli kwasu siarkowego(VI) H2SO4 oraz wodę utlenioną, czyli 3% roztwór H2O2. Mieszanina przybiera ciemne zabarwienie pochodzące od rozpuszczonego jodu. Nadmiar H2O2 usuwasz przy pomocy dwutlenku manganu MnO2, który znajduje się w masie wypełniającej ogniwa jednorazowe (np. z oznaczeniem R03);
- elektrolizer przeponowy (zlewkę przedzieloną tekturą) napełniasz roztworem KI, zanurzasz elektrody i włączasz przepływ prądu. Wydzielający się jod barwi obszar wokół elektrody dodatniej. Gotowy roztwór jodu pobierasz przy pomocy pipety lub strzykawki.
Wykorzystaj wodę jodową do próby, w której wykryjesz wiązania podwójne w składnikach oleju roślinnego. Do probówki nalej kilka cm3 wody jodowej, a następnie taką samą objętość oleju. Wstrząśnij probówką i pozostaw ją do rozwarstwienia cieczy. Po rozdzielenia oleju i wody zauważysz, że dolna warstwa stała się bezbarwna (poprzednio była zabarwiona na ciemno). Woda jodowa reaguje zatem tak samo, jak woda bromowa (4).
Jodowy minutnik
Przemiana jodu w jodek i jodku w wolny jod jest podstawą niezmiernie atrakcyjnej grupy reakcji zwanych zegarowymi. Efekt w postaci nagłej zmiany koloru (na ogół z bezbarwnego, przezroczystego roztworu na granatowo) pojawia się po określonym czasie, który można w dodatku regulować. Jednak nazwa - moim zdaniem - jest myląca, a porównanie przebiegu reakcji do minutnika (zamiast zegara) byłoby trafniejsze. Podczas próby nie ma efektów upływającego czasu, a wynik pojawia się zupełnie jak terkot minutnika. W ogólnym zarysie przebieg reakcji jest następujący:
- jodki (wprowadzone do roztworu lub powstałe z jodu albo jodanu) są utleniane przez utleniacz do jodu;
- jod jest z powrotem redukowany do jodków przez reduktor;
- dwa pierwsze etapy powtarzają się na przemian, aż wyczerpie się zapas reduktora;
- pojawia się wolny jod, który nie jest już redukowany (w mieszaninie musi być stechiometrycznie więcej utleniacza niż reduktora) i który reaguje ze skrobią, raptownie barwiąc roztwór.
Tyle teorii, pora na eksperyment. Najpierw wersja profesjonalna.
Przygotuj: ok. 1% roztwór jodku potasu KI, ok. 0,1% roztwór tiosiarczanu sodu Na2S2O3, 3% roztwór nadtlenku wodoru H2O2 (woda utleniona), 3-4% kwas solny HClaq i wskaźnik skrobiowy. Do zlewki wlej 5 cm3 roztworu KI i 5 cm3 kwasu solnego. Zawartość może nieco ściemnieć z powodu utleniania jodku do wolnego jodu. Następnie dodaj 10 cm3 roztworu Na2S2O3 (mieszanina znów stanie się przezroczysta) i 1 cm3 wskaźnika skrobiowego. Dopełnij wodą do objętości 50 cm3. Wlej 5 cm3 wody utlenionej i obserwuj.
Efekt jest niezwykle widowiskowy: przez kilkanaście - kilkadziesiąt sekund nic się nie dzieje, aż nagle - jak za dotknięciem czarodziejskiej różdżki - zawartość naczynia staje się granatowa. Zmiana barwy jest błyskawiczna, chociaż na ułamek sekundy przed końcem możesz zauważyć w roztworze pojawiające się ciemne smugi (5).
zabarwi się na granatowo (po prawej).
Przeprowadziłeś właśnie najstarszą, znaną od ponad 150 lat, reakcję zegarową, od nazwiska odkrywcy zwaną reakcją Harcourta lub też zegarem jodowym. Mechanizm jest następujący:
- aniony jodkowe są powoli utleniane przez nadtlenek wodoru
- wolny jod jest szybko usuwany przez tiosiarczan sodu
- etapy 1 i 2 powtarzają się, aż wyczerpie się cały zapas tiosiarczanu, a wtedy wolny jod barwi skrobię.
Do pewnego stopnia możesz regulować moment pojawienia się zabarwienia, np. zwiększenie ilości dodanego tiosiarczanu sodu opóźni koniec reakcji. Spróbuj tak dobrać ilości reagentów w kilku naczyniach, aby uzyskać efekt kolejnego pojawiania się barwy.
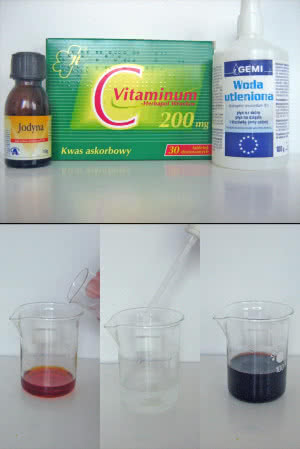
A teraz wersja, którą możesz wykonać "u cioci na imieninach" celem zadziwienia gości. Zmyj powłokę z tabletki witaminy C, rozgnieć ją i proszek rozpuść w 20-30 cm3 wody. Do naczynia wlej 20 cm3 wody i dodaj 1 cm3 jodyny. Następnie dodaj taką objętość roztworu witaminy C, która zawiera ok. 50 mg kwasu askorbinowego (na opakowaniu jest podana zawartość w jednej tabletce).
Brązowy roztwór jodu od razu się odbarwił (witamina C zredukowała go do jodku). Teraz dodaj nieco rozmieszanej z wodą mąki ziemniaczanej oraz 10 cm3 wody utlenionej. Po kilkunastu sekundach zawartość naczynia raptownie zabarwi się na ciemny kolor (6).
Mechanizm reakcji jest podobny do opisanego powyżej. W pierwszym etapie następuje redukcja jodu do anionów jodkowych pod wpływem kwasu askorbinowego. Następnie jony I– są utleniane przez nadtlenek wodoru do wolnego jodu, który ponownie ulega redukcji przy pomocy witaminy C. Dopiero po wyczerpaniu się całej ilości kwasu askorbinowego wolny jod reaguje ze skrobią, barwiąc zawartość naczynia. Przed publicznym pokazem przećwicz wszystko jednak w domu, aby uniknąć przykrej niespodzianki z powodu nieodpowiednio dobranych ilości odczynników.
Krzysztof Orliński
Zobacz także:
Te, które tworzą sole, część 5 Jod
Te, które tworzą sole - Chlor
Fluorowce