Chemiczny Nobel 2019

A więc nagroda za mobilność - bez ogniw litowo-jonowych nie byłoby telefonii komórkowej, laptopów, bezprzewodowych wiertarek, a nawet elektrycznych samochodów (przynajmniej w obecnej skali). Pojemne, długo działające i szybkie do naładowania akumulatory napędzają znaczną część naszego świata. Bez nich cywilizacja wyglądałaby zupełnie inaczej (1).
Lit to podstawa
W ogólnym zarysie ogniwo to układ dwóch różnych przewodników elektryczności (elektrody) zanurzonych w przewodzącym prąd roztworze (elektrolicie). Od dawna wiedziano, że na elektrodę ujemną najlepiej nadaje się lit: jest najlżejszym metalem (co zapewnia niską wagę ogniwa) i umożliwia osiągnięcie najwyższego napięcia.
Już ponad sto lat temu, w początkach XX wieku, podjęto próby konstrukcji ogniw litowych. Na przeszkodzie stanęły jednak właściwości chemiczne metalu: energicznie reaguje z wodą i powietrzem, a to wyklucza możliwość użycia wodnego elektrolitu. Z żalem porzucono zatem myśl o metalicznym licie jako materiale na elektrodę.
Przedwcześnie.
Potrzeba matką wynalazków
Mijały dekady, aż w początkach lat 70. ubiegłego wieku kolejne zawirowania polityczne na Bliskim Wschodzie spowodowały kryzys naftowy, którego efektami były gwałtowny wzrost cen ropy i ograniczenie jej podaży. Skończył się czas taniej benzyny i koncerny motoryzacyjne oraz paliwowe zaczęły szukać wyjścia z trudnej sytuacji. Naftowy gigant - Exxon - dał wolną rękę naukowcom poszukującym nowych źródeł energii.
Jednym z badaczy był brytyjski chemik M. Stanley Whittingham, który zajmował się pozornie odległą tematyką. W centrum jego zainteresowań leżała interkalacja jonów metali. Terminem tym określa się "wchodzenie" jonów pomiędzy warstwy innej substancji.
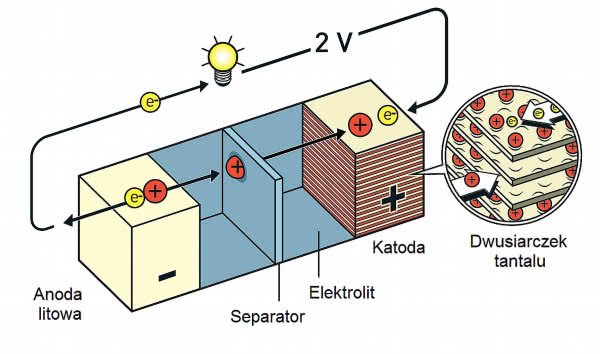
W toku pracy naukowiec zauważył, że jony potasu umieszczone pomiędzy warstwami dwusiarczku tantalu TaS2 stanowią nadspodziewanie dobrą katodę ogniwa (elektrodę dodatnią). Charakteryzowała się ona dużą gęstością energii, czyli ilością energii, którą można zmagazynować w jednostce masy lub objętości. Pojawiła się nadzieja na konstrukcję wydajnego akumulatora dla pojazdów elektrycznych.
W latach 50. ubiegłego wieku chemicy otrzymali niewodne rozpuszczalniki, w których - jak w wodzie - dysocjowały sole metali. Usunięta została więc główna przeszkoda stojąca na drodze konstrukcji ogniwa litowego. Gdy Whittingham przedstawił wyniki badań, zarząd Exxona od razu podjął decyzję o wdrożeniu do produkcji akumulatora opartego na licie.
Konstrukcja, którą zademonstrowano w roku 1976, składała się z metalicznego litu jako elektrody ujemnej (anody), niewodnego elektrolitu, w którym rozpuszczono sól litu (nadchloran LiClO4 lub heksafluorofosforan LiPF6) oraz katody z TaS2. Podczas pracy atomy litu oddawały elektrony i przepływały do katody, gdzie ulegały interkalacji pomiędzy warstwami dwusiarczku tantalu. Podczas ładowania akumulatora jony litu migrowały w odwrotnym kierunku (2).
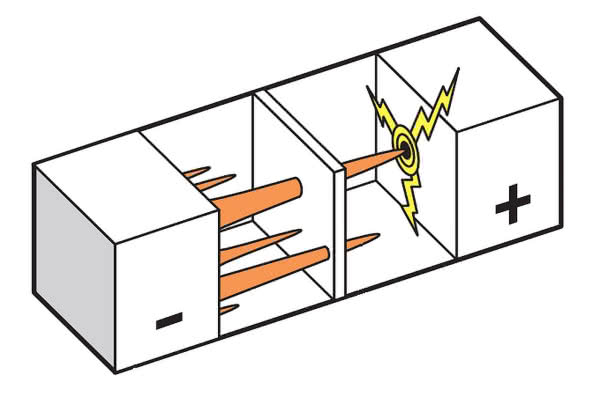
W trakcie użytkowania pojawiły się niespodziewane trudności. Podczas wielokrotnego ładowania akumulatorów na powierzchni elektrody litowej wyrastały "wąsy", czyli znane elektronikom whiskersy tworzące się na bezołowiowych lutach. W rezultacie dochodziło do zwarcia elektrod i uszkodzenia ogniw, co - ze względu na reaktywność litu - powodowało zapalenie się metalu i pożary (3). Sytuację poprawił dodatek aluminium do litu.
Kryzys paliwowy dobiegał jednak końca i Exxon zaprzestał finansowania dalszych badań. Akumulatory litowe nie przyjęły się na szerszą skalę.
Prace trwają dalej
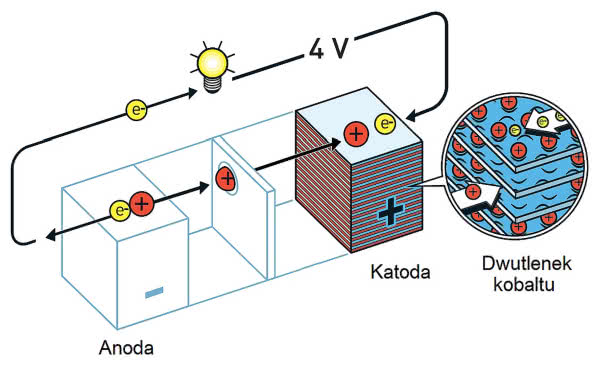
Następny z noblistów, John B. Goodenough, był przekonany, że zastąpienie siarczku, z którego zrobiona jest katoda, przez tlenek zwiększy napięcie pojedynczego ogniwa. Dzięki temu można ograniczyć łączenie szeregowe ogniw, co pozwala na zwiększenie sumarycznej pojemności układu przy zastosowaniu tej samej liczby elementów (zyskujemy na wydłużeniu czasu pracy i możliwości czerpania prądu o większym natężeniu).
Znalezienie odpowiedniej substancji nie było proste, ponieważ tylko nieliczne spełniają stawiane warunki. To, że musi ona mieć budowę warstwową, jest oczywiste, ale ponadto powinna być trwała podczas kolejnych cyklów ładowania i rozładowania ogniwa. Większość materiałów rozwarstwiała się pod wpływem ciągle wchodzących i wychodzących z niej jonów.
W roku 1980 poszukiwania przyniosły jednak efekt. Zastosowanie dwutlenku kobaltu CoO2, zmiana rozpuszczalnika oraz zawartej w nim soli litu (na tetrafluoroboran LiBF4) od razu podwoiły napięcie ogniwa: z 2 do 4 V.
Ponadto, w przeciwieństwie do poprzednich modeli, można było produkować ogniwa nienaładowane, które kupujący sam ładował przed użyciem. Nadal jednak nie rozwiązano problemu pojawiającego się podczas uszkodzenia obudowy - kontakt litu z powietrzem i wilgocią powodował zapłon (4).
Wreszcie litowo-jonowe
Lata 80. ubiegłego wieku były czasem gwałtownego rozwoju japońskiej elektroniki. Walkmany, kamery wideo, telefony bezprzewodowe, aparaty fotograficzne, miniaturowe odbiorniki radiowe - wszystkie one potrzebowały wydajnego zasilania, najlepiej akumulatorowego, aby zmniejszyć koszty eksploatacji.
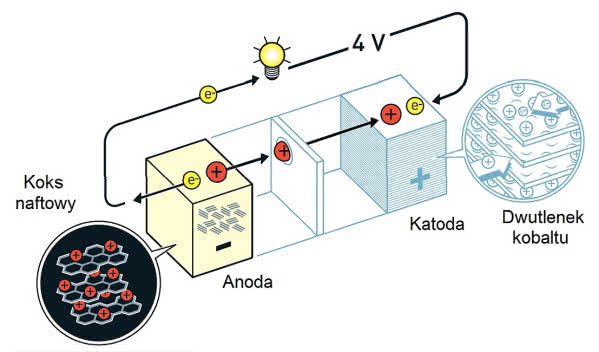
Akira Yoshino z Asahi Kasei Corporation postanowił ulepszyć konstrukcję Goodenougha przez rezygnację z metalicznego litu jako elektrody ujemnej. Początkowo zamiast niej stosował grafit, który również ma budowę warstwową (to dzięki temu grafit jest miękki i łatwo się ściera, co umożliwia użycie go jako wkładu do ołówków i smaru).
Po przyłożeniu ujemnego napięcia do elektrody grafitowej (substancja przewodzi prąd) jony litu wchodziły pomiędzy warstwy materiału, zaś dostarczane elektrony były "więzione" w strukturze grafitu. W trakcie pracy ogniwa elektrony przewodem odpływały na zewnątrz, a jony litu dążyły do elektrody dodatniej. Grafit okazał się jednak materiałem niestabilnym i podczas kolejnych cykli ładowania oraz rozładowania ulegał rozwarstwieniu.
Yoshino znalazł więc odpowiedni materiał. Koks naftowy, pozostałość po destylacji ropy naftowej, był odporny na rozwarstwianie podczas działania ogniwa. Klucz trwałości koksu stanowi jego budowa: warstwy grafitu otoczone przez bezpostaciowy węgiel.
Materiał jest więc kompozytem, w którym frakcja bezpostaciowa spaja warstwy i zapobiega ich rozdzielaniu (5). W późniejszym czasie powrócono do grafitu jako materiału elektrodowego dzięki zastosowaniu odpowiednich rozpuszczalników w roli elektrolitu (osadzają się na powierzchni elektrody, zapobiegając jej zniszczeniu).
Konstrukcja nie zawierała metalicznego litu i w razie uszkodzenia obudowy nie groził już pożar. Rok 1986 można uznać za moment narodzin akumulatora litowo-jonowego - na rynku pojawił się on pięć lat później.
Czasy współczesne i przyszłość
Ogniwa litowo-jonowe to rzecz powszechna w naszym otoczeniu, a prace nad ich udoskonaleniem trwają nadal. Są wszędzie. Mają je w sobie: smartfony i telefony komórkowe, laptopy i tablety, profesjonalny i amatorski sprzęt warsztatowy (wiertarki, wkrętarki itp.), a nawet samochody elektryczne (np. w "kosmicznej" Tesli Roadster znajduje się akumulator złożony z ponad 6800 pojedynczych ogniw).
Akumulatory z oznaczeniem "Li-ion" zapewniają nam świat bez kabli, a tendencja ta będzie tylko wzrastać.
Choć akumulatory litowo-jonowe są lekkie, trwałe, dają wysokie napięcie, mają dużą pojemność, nie wykazują efektu pamięciowego, wolno się samorozładowują, a ich produkcja i użytkowanie nie obciążają środowiska tak, jak w przypadku innych konstrukcji, nie są jednak niezniszczalne.
Szkodzi im rozładowanie "do końca", jak również przeładowanie oraz zbyt wysokie temperatury. Dlatego, dbając o stan swoich akumulatorów i zasilanego przez nie sprzętu, pamiętaj, aby naładować je jak najszybciej po wyczerpaniu, a gdy przez dłuższy czas nie będziesz z nich korzystał - przechowuje je naładowane do 40-60% całkowitej pojemności.
Nie pozostawiaj akumulatorów na słońcu, ani w pobliżu grzejników - zdecydowanie wolą pokojową temperaturę. Nie otwieraj nigdy ich obudowy, a zużytych nie wyrzucaj do zwykłych opadów, lecz zanieś do punktu zbiórki (oznaczone pojemniki znajdują się np. w sklepach ze sprzętem AGD, a może i w Twojej szkole).
Problematyka ogniw, nie tylko litowo-jonowych, nierozerwalnie wiąże się z fascynującą historią chemii. Powrócimy do niej już za miesiąc, natomiast doświadczeniami z samym litem zajmiemy się nieco później.
Laureaci
A co u konkurencji?
W ubiegłym roku Nagrodę IgNobla w dziedzinie chemii otrzymali portugalscy konserwatorzy zabytków, którzy do usuwania zabrudzeń używali poślinionego palca. W tym roku nagroda również została przyznana za badania nad śliną, a ściślej nad jej dzienną produkcją przez typowych pięciolatków. W uroczystości rozdania IgNobli wziął udział przedstawiciel laureatów - japońskich medyków z Uniwersytetu Meikai - wraz z "królikiem doświadczalnym", czyli swoim 35-letnim synem, który przed laty był obiektem badań ojca.
Ogniwa, baterie, akumulatory
Choć pojęcia te są często używane zamiennie (zwłaszcza dwa pierwsze), nie oznaczają tego samego. Ogniwo to pojedynczy układ generujący napięcie. Bateria to zespół połączonych ogniw: szeregowo - w celu zwiększenia napięcia ("+" jednego z "-" drugiego), równolegle - aby zwiększyć pojemność ("+" z "+" oraz "-" z "-"), lub też jako kombinacja obu tych sposobów. Akumulator to ogniwo lub złożona z nich bateria, które można powtórnie naładować po rozładowaniu (nie każdy rodzaj ogniw ma tę właściwość).
Zobacz także:
Polski akumulator rowerowy
TP-Link Neffos C5 - kompaktowy smartfon
Krzysztof Orliński