Na cześć złośliwych duchów (1)

Oba pierwiastki to towarzysze żelaza, razem z nim znajdujące się w jednej triadzie (patrz: Trójkami). Podobieństwo kobaltu i niklu do metalu najbardziej rozpowszechnionego na Ziemi powoduje, że poznając ich właściwości, nadal pozostaniesz w tematycznym "żelaznym kręgu" (tegoroczne artykuły działu chemicznego traktowały o żelazie, korozji oraz obrońcy stali - cynku).
Złośliwe duchy
Podobnie jak w przypadku innych pierwiastków, związki kobaltu znano od znacznie dawniejszych czasów niż sam metal. Już w starożytności cenione było niebieskie szkło, któremu kolor nadawał pigment otrzymywany z rudy kobaltu (1). Jednak umiejętność wytwarzania barwnika o pięknym, nasyconym kolorze zanikła w Europie, jak wiele innych wynalazków i osiągnięć technologicznych, wraz z upadkiem Cesarstwa Rzymskiego (w Chinach wytwarzano w tym czasie porcelanę zdobioną niebieskim barwnikiem kobaltowym).
Europejczycy ponownie poznali związki kobaltu w późnym średniowieczu, gdy Wenecjanie zaczęli stosować je do barwienia szkła. Odkrycie utrzymywano w ścisłej tajemnicy, co spowodowane było chęcią zachowania monopolu na wytwarzanie drogiego niebieskiego szkła. Jednak szpiegostwo przemysłowe nie jest wynalazkiem naszych czasów i z biegiem lat cała Europa poznała tajniki wyrobu kobaltowego barwnika - smalty.
Gdzie jednak kryją się duchy? Otóż do produkcji pigmentu używano szczególnej rudy. W Górach Kruszcowych (Rudawy leżące obecnie na pograniczu Czech i Niemiec) górnictwo kwitło od bardzo dawna. Saksońscy gwarkowie czasem znajdowali minerał podobny do rudy srebra, ale nie udawało się z niego otrzymać cennego metalu. Winne były oczywiście złośliwe górskie duchy - koboldy - zamieniające rudę srebra w bezwartościowy kamień. Stąd też nazwa minerału (kobold lub kobolt), którego reputację poprawiło użycie jako surowca do produkcji niebieskiego pigmentu (ale to jednak nie to co srebro).
Nikiel ma podobną historię. Zanim poznano go na Starym Kontynencie, już w starożytności wchodził w skład stopów używanych głównie do bicia monet (wtedy również nie znano niklu, a stopy wytwarzano z rudy zawierającej jego domieszkę). Nazwa pierwiastka pochodzi zaś od gwarowego słowa nicken, czyli m.in. oszukiwać (samo nickel oznaczało natomiast diabła). Rudawscy górnicy często znajdowali czerwonej barwy minerał, z którego mieli nadzieję otrzymać cenną miedź. Jednak, jak w przypadku kobaltu, wytop się nie udawał, za co winą obarczano siły nieczyste. Z tego też powodu rudę nazwano kupfernickel, co oznacza oszukańczą miedź lub miedzianego diabła.
Narodziny
Choć rudy kobaltu i niklu znane były już w średniowieczu, zawarte w nich metale świat ujrzał dopiero w wieku XVIII, a odkrywcami stali się Szwedzi (2). W roku 1735 Georg Brandt dokładnie zbadał minerał używany do produkcji niebieskiego pigmentu i wydzielił z niego metal (dość zanieczyszczony), któremu nadał nazwę kobalt. W końcu stulecia otrzymano już czysty metal, a w dalszych latach kobalt zastosowano jako składnik stopowy. Cały czas doskonalono również technologię produkcji błękitnego barwnika.
Kilkanaście lat później Axel von Cronstedt poddał analizie kupfernickel i stwierdził, że faktycznie w minerale nie ma miedzi, ale zawiera on nieznany składnik. Udało mu się go otrzymać w roku 1751, a srebrzystemu metalowi nadał nazwę nikiel.
Początkowo odkrycie nie spotkało się z zainteresowaniem, ponieważ zanieczyszczenia powodowały, że nikiel był kruchy. Dopiero otrzymanie czystego metalu ujawniło jego zalety: odporność na korozję i kowalność. W kolejnym stuleciu został użyty jako składnik stopów, m.in. stosowanych - jak przed wiekami - do wyrobu monet.
Złośliwe duchy ukryte w kobalcie i niklu sprawiły kłopot samemu Mendelejewowi. Dziś pierwiastki są ułożone w tablicy zgodnie z rosnącą liczbą atomową (liczbą protonów w jądrze), ale za czasów Mendelejewa o kolejności decydowała masa atomowa. Ponieważ jest ona na ogół proporcjonalna do liczby atomowej, możliwe było ustawienie pierwiastków w poprawnym porządku.
Jedynie w dwóch przypadkach kolejność została zaburzona: telluru i jodu oraz właśnie kobaltu i niklu (w końcu XIX wieku pojawiła się jeszcze jedna nieprawidłowa para - odkryty wtedy argon i znany już potas). Kobalt ma większą masę atomową niż nikiel i powinien znaleźć się za nim w szeregu, ale Mendelejew przestawił pierwiastki tak, aby - zgodnie z właściwościami chemicznymi - trafiły do odpowiednich grup. Kobalt wykazuje podobieństwo do leżących pod nim rodu i irydu, np. ze względu na tworzenie wielobarwnych związków, natomiast nikiel do doskonały katalizator przyłączania wodoru (jak pallad i platyna z tej samej rodziny). Wyznaczenie liczby atomowej pierwiastków, czego dokonano w początkach XX wieku, potwierdziło prawidłowość decyzji Mendelejewa.
Zasoby
Na liście rozpowszechnienia pierwiastków w powierzchniowej warstwie Ziemi nikiel zajmuje 23. miejsce, stanowiąc 0,01% masy tej części globu. Kobaltu jest mniej - 0,004% i 28. miejsce na liście. Jeżeli potraktujemy Ziemię jako całość, nikiel awansuje aż na 6. miejsce z prawie dwuprocentowym udziałem w masie planety. To oczywiście konsekwencja istnienia żelazno-niklowego jądra Ziemi o średnicy prawie 7000 km. Sytuacja jest odbiciem proporcji w Układzie Słonecznym i Wszechświecie: pomijając wodór i hel, żelazo i nikiel należą do najbardziej rozpowszechnionych pierwiastków. Maksimum trwałości jąder atomowych przypada w pobliżu żelaza, zatem jądra tam leżące dość łatwo się tworzą i trudno ulegają rozpadowi.
Nikiel to także typowy składnik meteorytów żelaznych, np. ogromne złoże rud tego metalu w kanadyjskim okręgu Sudbury powstało prawdopodobnie na skutek upadku gigantycznego przybysza z kosmosu około 2 miliardów lat temu. Kobalt jest znacznie rzadszy, ale pierwiastki o nieparzystej liczbie atomowej (kobalt ma 27 protonów w jądrze) są mniej rozpowszechnione niż ich "parzyści" kuzyni (to z kolei efekt mechanizmu nukleosyntezy).
Nikiel i kobalt tworzą własne minerały (kobalt przy tym często towarzyszy niklowi), ale występują również jako domieszki rud swoich sąsiadów z lewej i prawej - żelaza i miedzi. Proces produkcji jest dość skomplikowany i obejmuje szereg operacji chemicznych związanych z wydzieleniem metali z rud, a następnie rozdzieleniem niklu i kobaltu. Czyste metale otrzymywane są najczęściej przez elektrolizę ich soli, a niklu również metodą Monda (wykorzystuje się w niej łatwe tworzenie oraz rozkład lotnego połączenia niklu z tlenkiem węgla).
Najwięksi dostawcy niklu to Indonezja i Filipiny, a kobaltu - Demokratyczna Republika Konga. W roku 2020 światowa produkcja wyniosła 2,5 mln ton niklu i 140 tys. ton kobaltu. KGHM podczas otrzymywania miedzi uzyskuje rocznie kilka tysięcy ton siarczanu niklu.
Wodorotlenki
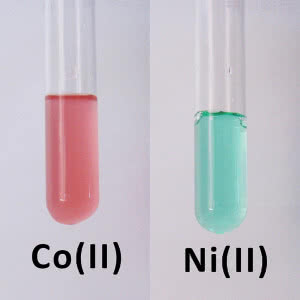
Najłatwiej dostępne związki kobaltu i niklu to chlorki lub siarczany(VI) sprzedawane w postaci soli uwodnionych. W roztworze wodnym trwałe są dwuwartościowe kationy tych metali: sole kobaltu mają w nim różowe zabarwienie, a niklu zielone (3). Podobny kolor mają krystaliczne sole uwodnione, ale bezwodne są innej barwy (tak zwykle dzieje się w przypadku związków metali z grup od 4 do 11) (4).
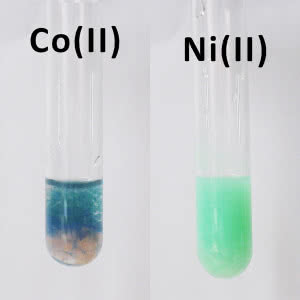
Pora na doświadczenia. Najpierw wodorotlenki mające duże znaczenie analityczne podczas wykrywania kationów niklu i kobaltu. Sporządź roztwory soli oraz roztwór wodorotlenku sodu NaOH. Po zmieszaniu roztworu soli danego metalu z zasadą zauważysz wytrącanie barwnych osadów: zielonego w roztworze soli niklu i niebieskiego dla kobaltu.
W pierwszym przypadku rzeczywiście powstaje wodorotlenek o wzorze Ni(OH)2, natomiast kobalt tworzy osad soli zasadowej (5). Początkujący analityk może pomylić go z osadem wodorotlenku miedzi, jednak Cu(OH)2 ma błękitną barwę w przeciwieństwie do wyraźnie niebieskiego związku kobaltu.
Ponadto, gdy nieco poczekasz, niebieska barwa zmieni się w brunatnoróżową. To efekt utleniania osadu do związku kobaltu trójwartościowego przez tlen z powietrza rozpuszczony w roztworze (w przypadku wodorotlenku miedzi nic takiego nie zaobserwujesz). Reakcja jest analogiczna do przypadku wodorotlenku żelaza(II), który także łatwo utlenia się do brunatnych połączeń żelaza(III). Teoretycznie przez ogrzewanie niebieskiego osadu mógłbyś uzyskać czerwonoróżowy Co(OH)2, ale nie będziesz w stanie zapewnić braku dostępu tlenu i zawsze powstanie związek kobaltu(III).
W przypadku wodorotlenku niklu(II) nie zaobserwujesz zmian barwy, ponieważ nie ulega on wpływowi tlenu z powietrza, potrzebny jest silniejszy czynnik utleniający. Dodaj nieco wody utlenionej (3% roztwór H2O2) lub kilka kropli perhydrolu (30% roztwór; ostrożnie, odczynnik żrący!). Zielony osad natychmiast przechodzi w czarny Ni(OH)3. Nadtlenek wodoru spowoduje również szybkie utlenianie niebieskiego osadu związku kobaltu do brunatnego Co(OH)3 (6).
Przeprowadzone reakcje potwierdzają podobieństwo kobaltu i niklu do żelaza. Sole metali dwuwartościowych reagują z wodorotlenkami, dając trudno rozpuszczalne, barwne osady. W przypadku żelaza i kobaltu następuje utlenianie powstałych związków tlenem z powietrza do połączeń, w których metal jest trójwartościowy (szybciej w przypadku żelaza niż kobaltu).
Wodorotlenek niklu(II) jest odporny na działanie powietrza, ale ulega silniejszym utleniaczom, np. nadtlenkowi wodoru (podobnie jak analogiczne połączenia żelaza i kobaltu). Powstające związki mają ciemniejsze barwy: brunatne w przypadku żelaza i kobaltu oraz czarną dla niklu. Wodorotlenki żelazowców nie są amfoteryczne: rozpuszczają się oczywiście w kwasach, ale nie reagują z nadmiarem dodanej zasady.
Krzysztof Orliński