Ogień bez zapałek

Także i chemia rozpoczęła się od ognia. To dzięki niemu możliwe były jej pierwsze praktyczne zastosowania - wytop metali z rud, produkcja szkła i ceramiki. Piec do ogrzewania substancji był sercem każdej alchemicznej pracowni, a i dziś, mimo coraz powszechniejszego ogrzewania elektrycznego i mikrofalowego, trudno wyobrazić sobie chemiczne laboratorium bez gazowych palników (1).
Ogień w oczach chemika
W powyższym śródtytule nie chodzi oczywiście o pełne zapału spojrzenie eksperymentatora, gdy uda mu się szczególnie efektowna i trudna reakcja, ale o naukowy rzut oka na bohatera dzisiejszego artykułu. Ogień to efekt gwałtownie przebiegającego procesu utleniania, któremu towarzyszy wydzielanie znacznych ilości ciepła oraz światła. Do utleniania potrzebny jest utleniacz - zazwyczaj tlen, ale np. fluor i chlor są tak aktywne, że i one wywołują reakcje wizualnie podobne do spalania.
Oprócz utleniacza w reakcji bierze także udział substancja, która sama może się utleniać. To jednak nadal nie wystarczy. Aby reakcja zaczęła zachodzić, potrzebne jest jeszcze dostarczenie pewnej porcji energii, tzw. energii aktywacji. To dzięki niej pierwsze cząsteczki zaczynają ze sobą reagować, wydzielone ciepło pobudza kolejne molekuły, te zaś następne itd. Reakcja zaczyna przebiegać coraz szybciej, czasem prowadząc do wybuchu.
Pamiętaj więc o trzech czynnikach potrzebnych do powstania ognia: tlenie, palnej substancji oraz inicjatorze reakcji.
Dla przykładu: mieszanina wodoru z tlenem jest jedną z najbardziej wybuchowych, ale latami może być przechowywana bez najmniejszych oznak reakcji. Wystarczy jednak mała iskra, aby eksplodowała.
Od niepamiętnych czasów wiedziano, że do podtrzymywania ognia potrzebne jest powietrze. Jednak ograniczona jego ilość była w stanie umożliwić palenie tylko przez pewien czas. Ta obserwacja sugerowała obecność w powietrzu jakiegoś czynnika podtrzymującego palenie, który w dodatku zużywał się podczas procesu. Dziś wiemy, że to tlen, a w odkryciu jego roli zasłużył się polski alchemik Michał Sędziwój (patrz: "Tajemnice tlenu", MT nr 7-8/2017).
Inna obserwacja na prawie wiek sprowadziła jednak teorię spalania na manowce. Zauważono, że pozostałość po spaleniu substancji organicznych i węgla waży znacznie mniej niż paliwo, zatem muszą one tracić jakiś składnik. U schyłku XVII wieku nazwano go flogistonem (z gr. phlogistos = palny) i uważano za składnik każdego ciała palnego. Podczas spalania miał on przechodzić do powietrza, a gdy to nasyciło się flogistonem, ogień gasł. Zużyte powietrze regenerowało się przy udziale roślin (idea nie była więc do końca mylna). Proces spalania oznaczał po prostu przechodzenie flogistonu z jednej substancji do drugiej.
Przykładowo: metal ogrzewany na powietrzu wydziela flogiston i zamienia się w niepalną ziemię (jak wtedy nazywano tlenek tego metalu). Gdy zaś ogrzewano ziemię (np. rudę metalu) z zawierającym dużo flogistonu węglem, czynnik ten z węgla przechodził do tlenku metalu, ponownie tworząc czysty metal.
Teoria na pozór prezentowała się logicznie i tłumaczyła wiele zjawisk - np. rdzewienie uważano za powolne spalanie. Jednak powszechne użycie wagi w XVIII-wiecznych pracowniach chemików spowodowało zakwestionowanie jej podstaw. Okazało się, że otrzymana ziemia waży więcej niż metal, z którego powstała. W ujemną zaś masę flogistonu w tych czasach nikt już nie wierzył.
Dopiero gdy w bilansie masy substratów i produktów uwzględniono również substancje gazowe (do tej pory wymykające się badaczom), wszystko stało się jasne. Spalanie to nie utrata flogistonu, lecz łączenie się substancji z tlenem. Od wyjaśnienia procesu spalania w końcu XVIII wieku rozpoczęła się nowoczesna chemia.
Bez zapałek
Zapałki w znanej nam postaci mają niecałe dwieście lat, ale człowiek radził sobie z rozpalaniem ognia już wiele tysięcy lat wcześniej. Początkowo chodziło tylko o użycie ognia naturalnie pojawiającego się w wyniku pożarów wzniecanych uderzeniem pioruna. Stopniowo nauczono się podtrzymywać tak zdobyty płomień, choć zawsze groziło jego wygaśnięcie, a i pioruny nie biły na zawołanie. Koniecznością stała się umiejętność samodzielnego rozniecania ognia.
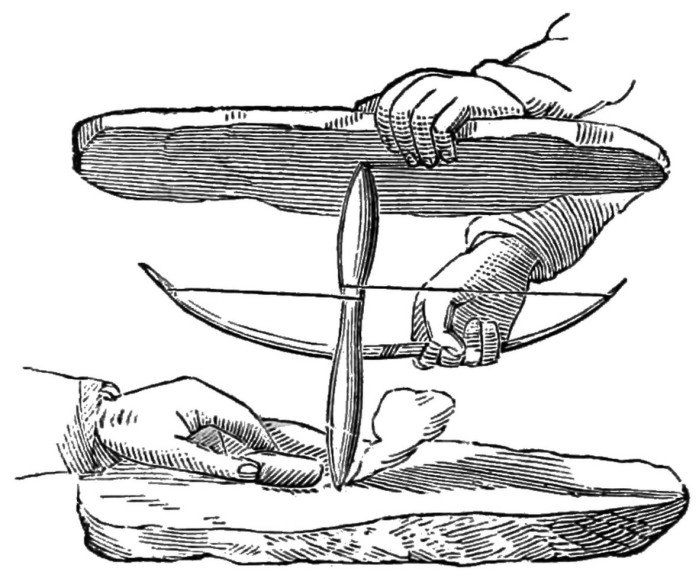
Tlen był w powietrzu, jakaś palna substancja też zawsze się znalazła, potrzebny był tylko zapłon, a ściślej - lokalne podniesienie temperatury powyżej temperatury zapłonu. Najpierw zauważono, że można to zrobić przez tarcie, np. dwóch kawałków drewna. Do dziś prymitywne plemiona tym sposobem rozpalają ogień, a pracę ułatwia tzw. łuk ogniowy.
W cięciwę łuku włożony jest drewniany pręt. Jeden z końców pręta trzymamy w ręce, a drugi obraca się we wgłębieniu deseczki. Szybkie ruchy łuku powodują obrót pręta i wytworzenie wysokiej temperatury we wgłębieniu, do którego wystarczy wtedy przytknąć np. wysuszoną trawę. Łuk ogniowy jest stosowany także we współczesnym surwiwalu (2).
Pierwotni ludzie obrabiający kamienne narzędzia zauważyli, że niektóre z nich iskrzą przy uderzeniu. Przez tysiące lat ogień rozpalano więc, uderzając kawałkiem krzemienia w piryt. Po wytopieniu żelaza nastąpił przełom w krzesaniu ognia. Uderzenie żelaznego pręta w krzemień powodowało wytworzenie iskier, które - padając na odpowiednio przygotowaną podpałkę - wzniecały płomień. Od tej pory przez wieki ludzie nosili trzy rzeczy w przytroczonym do pasa woreczku: krzemień, żelazne krzesiwo i hubkę zapalającą się od krzesanych iskier (nazwa pochodzi od rosnącego na drzewach grzyba, którego wysuszony miąższ jest łatwo palny; ale stosowano i inne substancje, np. suchy mech). Krzesiwa używane są zresztą i dziś, np. we wspomnianym już surwiwalu (3).
(fot.: Wikimedia/Toyah, Wikimedia/KEN).
Inne techniki wykorzystują ciepło skupionych promieni słonecznych. Do rozpalenia ognia wystarczy tu cierpliwe trzymanie soczewki - dawniej używano rybich pęcherzy wypełnionych wodą. Można spróbować z plastikową butelką lub torebką, ale w naszym klimacie Słońce nie zawsze świeci z wystarczającą mocą, a niebo mogą zakrywać chmury. Pewniejszy sposób znajdziesz w następnym rozdziale.
Chemik sobie poradzi
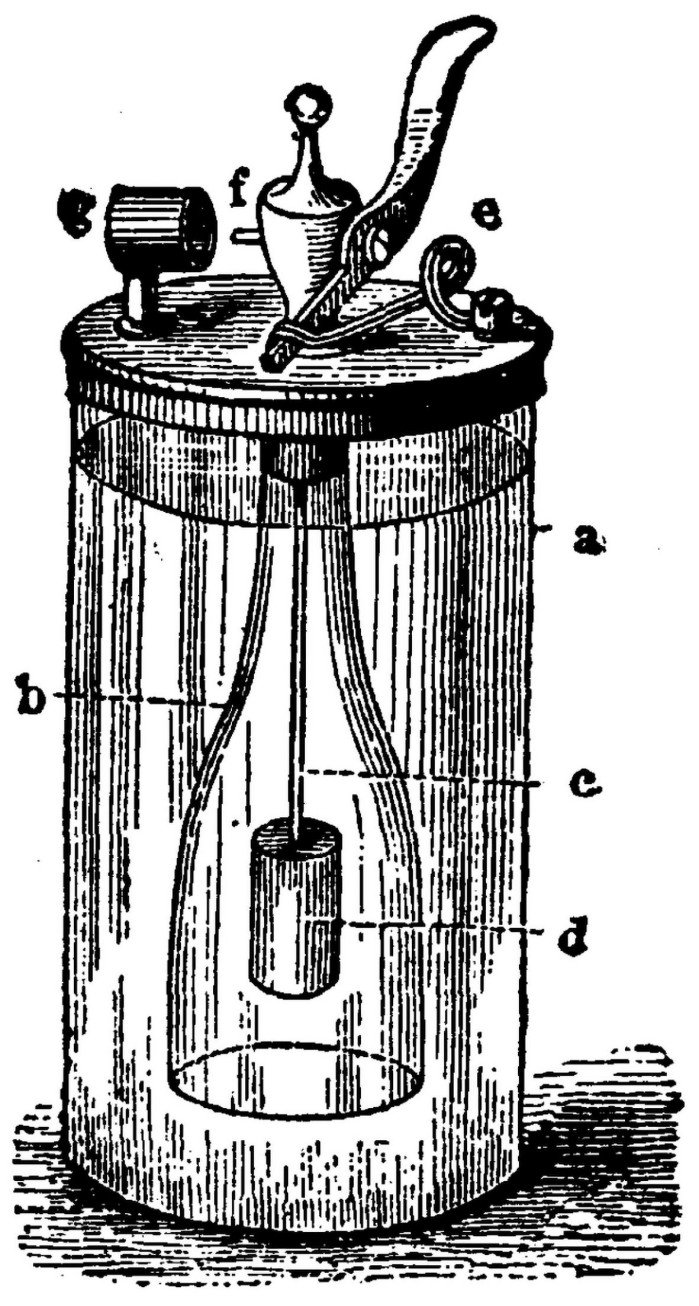
Ognisko zwykle zapalamy przy pomocy zapałek lub zapalniczki. Co jednak zrobić, gdy te pierwsze zamokły, a wśród biwakowiczów nie ma palaczy? Oprócz omówionych w poprzednim rozdziale metod bazujących na zjawiskach fizycznych, chemicy mają także własne sposoby na wywołanie zapłonu. Zanim do powszechnego użycia weszły zapałki, stosowano "chemiczne zapalniczki", jednak były one niewygodne w użyciu i wymagały niezbyt bezpiecznych reagentów. Popularna w początkach XIX wieku zapalniczka Döbereinera wykorzystywała fakt samorzutnego zapalania się wodoru (otrzymanego w reakcji kwasu siarkowego z cynkiem) na katalizatorze platynowym (4).
Znane są reakcje chemiczne prowadzące do zapłonu substancji. Jednak wiele z nich łatwo wymyka się spod kontroli, albo też wymaga użycia silnie żrących lub toksycznych reagentów. My będziemy zatem stosować odczynniki tanie, łatwo dostępne i - co najważniejsze - bezpieczne, przy zachowaniu zwykłych zasad BHP postępowania z chemikaliami (nie różnią się one wiele od np. tych obowiązujących w przypadku używania domowych środków czystości).
Uwaga! Pierwsze próby wykonaj jednak z dala od łatwopalnych przedmiotów (najlepiej na wolnym powietrzu) i miej pod ręką środki gaśnicze (np. piasek), gdyby reakcja wymknęła się spod kontroli. Pamiętaj również o zapewnieniu ochrony swoich oczu i skóry dłoni.
Potrzebny ci będzie manganian(VII) potasu KMnO4, popularnie zwany nadmanganianem lub "kali". Bez trudu dostaniesz go w aptece lub drogerii, gdzie jest sprzedawany jako środek dezynfekcyjny. Unikaj zabrudzenia dłoni lub odzieży ciemnofioletowymi kryształami tego związku, ponieważ szybko powstają trudno usuwalne brązowe plamy. W laboratoriach i zastosowaniach medycznych wykorzystuje się utleniające właściwości nadmanganianu. Będąc w aptece lub drogerii, zaopatrz się także w glicerynę (glicerol). Ta nietrująca, słodka ciecz stosowana jest m.in. do pielęgnacji skóry.
Pora na próbę.
Kryształy nadmanganianu utrzyj w moździerzu na proszek i przesyp do porcelanowej parowniczki ustawionej na niepalnym podłożu. Na powierzchnię proszku dodaj kilka kropli gliceryny. Wkrótce zauważysz biały dym, a potem płomień, od którego zapalisz kartkę papieru. Gdy płomień zgaśnie, pozostałość będzie żarzyć się jeszcze przez pewien czas (możesz dodać jedną lub dwie porcje gliceryny, aby powtórzyć próbę). Gdybyś miał problemy z zapłonem, zwilż powierzchnię nadmanganianu kroplą wody (lecz tylko jedną!). Utarcie KMnO4 na proszek przyspiesza zapłon, ale reakcja wyjdzie i z większym kryształami (5).
Na biwak weź więc utarty na proszek nadmanganian w foliowym woreczku z zapięciem strunowym (lub innym szczelnym pojemniku) i plastikową buteleczkę gliceryny. Gdy zechcesz rozpalić ognisko, na kawałku papieru usyp stożek z KMnO4 i polej go niewielką porcją gliceryny.
Drugi sposób również wymaga użycia nadmanganianu potasu, ale potrzebny będzie także stężony roztwór kwasu siarkowego(VI) H2SO4 (w tym przypadku koniecznie chroń oczy i skórę). Jako palnej substancji użyj acetonu lub zmywacza do lakieru. Kawałek papieru (np. chusteczkę higieniczną) zwilż niewielką ilością acetonu. Koniec szklanej bagietki zanurz w roztworze kwasu siarkowego, a następnie włóż do pojemnika z KMnO4 - tak, aby przykleiło się kilka kryształów związku. Gdy dotkniesz końcem bagietki do papieru, po chwili zajmie się on ogniem. Polecam ci jednak pierwszy sposób jako bezpieczniejszy (6).
Zatem: silny utleniacz (KMnO4; w drugim przypadku reakcję przyspiesza dodatek mocnego kwasu) + palna substancja (gliceryna czy aceton) = ogień. Nawet bez zapałek chemik sobie poradzi i rozpali ognisko.

…ale nie w lesie, bo może skończyć się to dotkliwym mandatem (o wybuchu pożaru już nie wspominając). Na niektórych leśnych parkingach znajdują się miejsca przeznaczone na ognisko, specjalnie przygotowane przez służby leśne. Ognisko możemy też rozpalić na własnym terenie lub podczas biwaku, ale w odległości nie mniejszej niż 100 metrów od lasu. Zawsze należy zadbać, aby w pobliżu nie było łatwo palnych przedmiotów, i nie pozostawiać ognia bez nadzoru. Po zakończeniu palenia resztki należy zalać wodą lub zasypać piaskiem.
Krzysztof Orliński